Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Titolazione di una
soluzione di HCl con una soluzione di NaOH 0,1 M
(prof. Augusto Biasotti)
- Titolazione: procedimento che permette di determinare la concentrazione di una soluzione di un acido a titolo incognito mediante neutralizzazione con una soluzione di una base a molarità definita.
- Titolo: concentrazione molare.
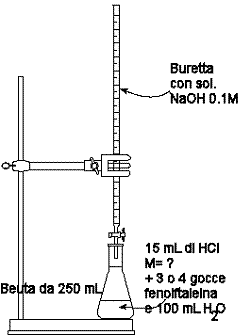
Si prelevano mediante una pipetta graduata, ad esempio, 15 mL di
una soluzione di acido cloridrico di
cui si vuole determinare il titolo e si travasano in una beuta da
250 mL, si aggiungono circa 100 mL di acqua distillata per
aumentarne il volume e 3 o 4 gocce di una soluzione di un indicatore
acido-base, nel nostro caso fenolftaleina,
che in ambiente acido è incolore.
In soluzione l’HCl è completamente
dissociato in ioni H+ e Cl- e il pH della soluzione è compreso tra 1
e 2.
La fenolftaleina è incolore in ambiente
acido e neutro e colore rosso in ambiente basico.
Si riempie la beuta, fissata ad un sostegno verticale, con la
soluzione di NaOH 0,1 molare e, agendo
sul rubinetto, si riporta il livello del liquido esattamente sullo
0.
Nella soluzione l’NaOH la base è completamente
dissociata in ioni Na+ ed OH- e il pH della soluzione è circa 13.
Si avvia la titolazione facendo defluire a goccia a goccia la
soluzione della base nella beuta, in essa avviene la seguente
reazione di neutralizzazione:
NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
Si interrompe l’aggiunta della base quando la soluzione nella
beuta assume un tenue colore rosa (viraggio dell’indicatore) perché
in questo istante tutto l’acido è stato neutralizzato e il colore
rosa dell’indicatore indica che il pH della soluzione è passato da
acido a basico.
Si legge sulla buretta il volume in mL di soluzione di NaOH utilizzato e si annota il relativo valore per poi effettuare i calcoli.
Es. sono stati gocciolati 18 mL di NaOH 0,1 M.
Dalla reazione: NaOH + HCl NaCl + H2O ,
1 mole 1 mole 1 mole 1 mole
risulta che una mole di HCl neutralizza una mole di NaOH , pertanto
quando tutto l’acido presente nella beuta è stato neutralizzato
dalla base, il numero di moli di di HCl presente nei 15 mL di
soluzione è uguale al numero di moli di NaOH presente nei 18 mL di
soluzione fatti defluire dalla buretta.
Calcolo
della molarità della soluzione di HCl: 18 mL = 0,018 L n° moli di NaOH in 18 mL = M x V (L) = = 0,1 moli/ L x 0,018 L = 0,0018 moli di NaOH Quindi anche in 15 mL di acido saranno presenti 0,0018 moli di HCl . 15 mL = 0,015 L La soluzione di HCl è 0,12 M. |
|
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |