 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Introduzione alla spettroscopia
del prof. Augusto
Biasotti
(Scarica la versione
stampabile  )
)
Rifrazione della luce
Quando un raggio di luce passa da una sostanza trasparente ad un'altra anch'essa trasparente, ma di densità diversa, subisce una deviazione. Tale fenomeno è detto rifrazione.
Il raggio incidente, passando dall'aria al vetro, è stato deflesso verso la normale (normale=perpendicolare) alla superficie di separazione dei due mezzi; nel passaggio opposto il raggio è stato, invece, allontanato dalla normale.
L'angolo di rifrazione dipende dalla densità della sostanza trasparente.
Dispersione della luce
Quando un raggio di luce bianca colpisce obliquamente un prisma di vetro trasparente viene scomposto in tanti raggi di luce di diversi colori.
Newton propose la seguente interpretazione del fenomeno:
- La luce bianca è in realtà una mescolanza di luce di diversi colori.
- Il prisma di vetro non crea la luce di diversi colori, ma semplicemente separa i colori già contenuti nella luce bianca.
- La separazione dei colori è dovuta al fatto che la deviazione dipende dalla lunghezza d'onda del raggio incidente.
L'immagine che si può raccogliere su uno schermo o su una pellicola fotografica è detta spettro e mostra una serie di colori sfumati dal rosso al violetto.
L'analisi
dello spettro mostra come la radiazione rossa ( l = 750 nm) venga deviata meno della radiazione violetta
( l = 350 nm ).
Tale spettro viene definito anche come spettro di emissione continuo. Danno spettri continui tutti i corpi incandescenti: solidi e liquidi.

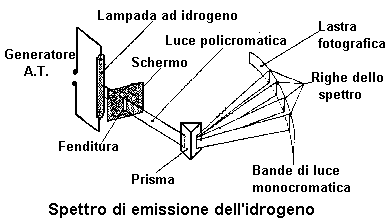
Spettri di emissione
Scomponendo con un prisma di vetro un raggio di luce proveniente da una lampada contenente idrogeno gassoso si osserva la formazione di uno spettro caratteristico costituito da quattro righe distinte su fondo nero. Dette linee si trovano due sul violetto una sull'azzurro ed una sul rosso.
Cambiando il gas contenuto nella lampada cambia anche lo spettro di emissione ottenuto.
In tali spettri non si osserva alcuna successione di colori sfumati, ma solo righe nette, colorate e su fondo nero.
Essi sono
tipici di gas incandescenti a bassa pressione. Il numero di righe, il loro
colore e la loro lunghezza d'onda
( l ) variano al variare del gas considerato.
Ogni elemento gassoso o reso gassoso ha il proprio spettro di emissione.
Spettri di assorbimento
Quando un gas o un vapore, a temperatura inferiore di quella della sorgente di luce bianca, viene interposto tra la sorgente stessa e lo spettroscopio, si ottiene uno spettro di assorbimento; esso presenta una o più righe nere ( di assorbimento ) su un fondo colorato continuo.
Confrontando lo spettro di emissione a quello di assorbimento di una stessa sostanza si vede che le righe nere nello spettro di assorbimento cadono nella stessa posizione ( stessa l ) delle righe colorate dello spettro di emissione. I due spettri si corrispondono come una foto al proprio negativo.
Si può concludere affermando che tutte le sostanze assorbono radiazioni luminose della stessa lunghezza d'onda (l) e frequenza (n) di quelle che sono in grado di emettere. La spettroscopia è un utilissimo mezzo di analisi chimico-fisica delle sostanze.
Interpretazione dello spettro di emissione dell'idrogeno
secondo il modello atomico di Bohr
La regolarità dello spettro di emissione di un elemento, cioè il fatto che esso era sempre formato dalle medesime e caratteristiche radiazioni, indipendentemente dalla sua provenienza e da eventuali procedimenti di eccitazione cui fosse stato sottoposto, non trovava alcuna valida spiegazione con il modello proposto da Rutherford nel 1911. Il primo ad affrontare il problema, su basi matematiche, fu Niels Bohr nel 1913.
Bohr accettò il modello planetario proposto da Rutherford e, per spiegare la regolarità di comportamento dello spettro di emissione dell'idrogeno, introdusse alcuni postulati tratti dalla meccanica quantistica.
Nell'atomo di idrogeno l'elettrone si muove lungo orbite circolari preferenziali ( orbite stazionarie ) caratterizzate ognuna da un determinato raggio e da una determinata quantità di energia ( livelli energetici ). Quando l'elettrone percorre tali orbite l'atomo di H non emette nè assorbe energia. Tali orbite vennero indicate con le lettere K, L, M, N, O, P, Q. A ciascuna orbita venne, inoltre, associato un numero intero positivo detto numero quantico ( K: n=1; L: n=2; M: n=3; etc.). Bohr determinò, poi, i raggi delle orbite: K: r=0.052 nm; L: r=0.212 nm; M: r=0.477 nm, etc..
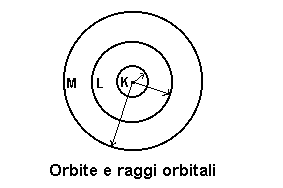
Nell'atomo non eccitato l'elettrone percorre l'orbita più vicina al nucleo ( orbita K ); tale orbita è caratterizzata dal valore minimo di energia, indicato come E0 ( si legge: e con zero ), rispetto a quelli delle altre orbite. A tutte le altre orbite descritte dall'elettrone, le energie delle quali aumentano a mano a mano che ci si allontana dal nucleo, corrispondono stati eccitati ( E1, E2, etc. ).
Si
verifica emissione di energia sotto forma di onde elettromagnetiche solo
quando un elettrone salta da un orbita stazionaria ad energia maggiore ad
un'altra ad energia minore.
Il quanto di energia emessa, DE ( si legge: delta e)
corrisponde alla differenza tra l'energia dello stato stazionario di partenza
e quello di arrivo dell'elettrone. Ad esempio, se all'atomo di idrogeno viene
somministrata energia dall'esterno, l'elettrone salta dallo stato fondamentale K , ad energia E0 , allo stato eccitato L ( E1 ) e, senza una
ulteriore eccitazione esso ritorna allo stato fondamentale K ;
l'energia ceduta è data dalla formula DE = E1 - E0 , ove E1 indica l'energia dell'elettrone nell'orbita L ed E0 l'energia nell'orbita K.
La frequenza ( n ) della radiazione emessa è data dalla formula DE
= h · n ove h è detta costante di Plank, il cui valore è
6.63 ·
10 -34 J s.
La
frequenza è legata alla lunghezza d'onda ( l ) della radiazione dalla formula n = c / l , ove c è la velocità della luce, ovvero
3.00 · 108 m / s.
Ad ogni transizione elettronica ( salto ) corrisponde una riga dello spettro. Poichè le orbite percorribili dall'elettrone sono ben definite, le transizioni elettroniche possibili da un'orbita alla precedente risultano in numero limitato. L'energia emessa sotto forma di radiazione elettromagnetica risulta costituita da quantità discrete ( discontinue ); le frequenze e le lunghezze d'onda delle varie radiazioni risultano pure discrete e coprono una parte molto piccola dello spettro visibile.
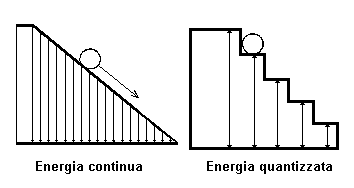
La formula con la
quale si ricava l'energia potenziale Ep è la seguente: Ep = m · g · h , ove:
m = massa in kg,
g = forza di accelerazione gravitazionale = 9.8 m / s2
h = altezza in metri.
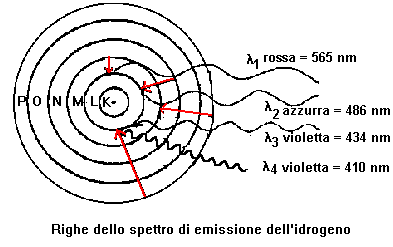
Da studi spettroscopici accurati risulta che le quattro righe dello spettro dell'idrogeno nel visibile provengono dalle seguenti transizioni elettroniche:
l1 ( rosso ): radiazione con notevole lunghezza d'onda e bassa frequenza.
l4 ( violetto ): radiazione con piccola lunghezza d'onda ed alta frequenza.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |