 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Materia ed Energia
del prof. Augusto Biasotti
L'energia viene definita, operativamente come l'attitudine di un corpo a compiere un lavoro. Le unità di misura dell'energia e del lavoro sono le stesse : il joule nel S.I. e la caloria come unità di misura empirica , 1 cal. = 4,18 J .
L'energia si può presentare in diverse forme , le principali sono: meccanica, elettromagnetica , termica, chimica, nucleare e radiante.
L'energia non può essere né creata né distrutta , ma può essere trasformata da una forma all'altra , può essere trasportata ed immagazzinata.
Principio di conservazione dell'energia
L'energia totale dell'universo resta costante. Materia ed energia sono strettamente legate : la materia può essere considerata come un magazzino dell'energia . Quando avviene una trasformazione della materia cambia, di conseguenza, il contenuto di energia di questo magazzino.
L'energia dei corpi materiali è di due tipi : potenziale e cinetica. L'energia potenziale è l'energia posseduta da un corpo, in un campo di forze , in virtù della sua posizione. Anche se il corpo è immobile essa è sempre presente e si manifesta quando si trasforma in un'altra forma di energia.
Due particelle con carica elettrica , mantenute ferme e vicine , possiedono energia potenziale:
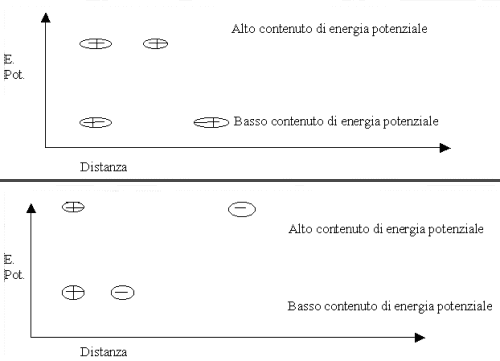
L'energia "nascosta" nel sistema tende a generare un movimento: le particelle si allontanano spontaneamente nel primo caso e si avvicinano nel secondo , una parte dell'energia potenziale si trasforma in energia cinetica.
Altri esempi sono l'energia gravitazionale e l'energia presente in una molla compressa. L'energia cinetica è una forma di energia che i corpi possiedono quando sono in movimento, ed è tanto maggiore quanto più alte sono la velocità e la massa del corpo.
Le particelle che costituiscono le sostanze ( molecole, atomi e ioni ) possiedono "nel loro piccolo" queste due forme di energia: cinetica e potenziale. Le molecole dei gas (dei liquidi e dei solidi), sono in continuo movimento e quindi a ciascuna di esse compete una certa quantità di energia cinetica.
Ovviamente al movimento delle particelle non corrisponde un movimento del corpo da esse costituito, ma quella forma di energia chiamata energia termica. L'energia termica posseduta da un corpo è una grandezza estensiva proprio perché dovuta alla somma dell'energia cinetica di tutte le particelle che lo costituiscono.
Un insieme di particelle (atomi , molecole o ioni ) può essere considerato un " deposito" di energia potenziale. Tale forma di energia è il risultato delle molteplici interazioni di tipo elettromagnetico che si stabiliscono tra le particelle (legami tra gli atomi , tra gli ioni , tra le molecole , eccetera ) , per questo motivo essa viene chiamata energia chimica.
Si tratta comunque di energia potenziale , o di posizione , perché determinata dalla reciproca disposizione delle particelle con le relative interazioni di tipo attrattivo e di tipo repulsivo. Gli atomi , infatti, sono formati da particelle con carica elettrica, gli elettroni e i protoni, ed ogni particella genera, anche se di intensità infinitesima , un campo di forze che agisce sulle particelle circostanti.
Mentre l'energia termica aumenta o diminuisce quando si riscalda o si raffredda la materia, l'energia chimica è più "nascosta" e si rende manifesta solo quando la materia si trasforma, cioè quando avvengono reazioni chimiche o cambiamenti di stato di aggregazione poiché questi fenomeni modificano le reciproche disposizioni e le forze tra le particelle.
Durante i passaggi dallo stato solido a quello liquido e poi a quello aeriforme si verifica la rottura dei legami intermolecolari che tengono unite le particelle. Per compiere questa operazione occorre spendere energia ed è per questo che, per passare dallo stato solido a quello gassoso, occorre fornire energia al sistema : questi passaggi di stato sono quindi processi endotermici.
Quando si passa dallo stato gassoso a quello liquido e poi allo stato solido avviene il processo inverso, ed i legami tra le particelle si ricompongono : questi processi sono pertanto esotermici e per farli avvenire occorre raffreddare il sistema, cioè sottrarre calore. La quantità di calore , ceduta o acquistata , da una determinata quantità di sostanza, durante un passaggio di stato si chiama calore latente.
Durante i passaggi di stato la temperatura rimane costante, infatti si verifica la rottura o la formazione di nuovi legami, ossia una variazione della quantità di energia chimica posseduta dal corpo. Ad esempio, durante la fusione il calore fornito ( calore latente di fusione ) si trasforma in energia chimica, e non modifica la quantità complessiva di energia termica , per cui il corpo fonde a temperatura costante.
Durante la solidificazione , invece , una parte dell'energia chimica si trasforma in calore ( calore latente di solidificazione ) cosicché la sostanza , pur sottraendo ad essa calore durante il passaggio di stato , mantiene la temperatura costante.
Il contenuto complessivo di energia delle sostanze è stato definito energia interna, essa si compone di : energia cinetica + energia potenziale delle particelle.
E potenziale = energia di legame
Nei gas monoatomici è presente energia potenziale ed energia traslazionale. L'energia delle sostanze è assai complessa ed impossibile risulta determinarne il valore assoluto. In fisica e in chimica interessano soprattutto le variazioni di energia interna: DE .
Le reazioni chimiche sono sempre accompagnate da scambi di energia con l'ambiente esterno. Se la reazione produce calore si dice esotermica, se per procedere ha bisogno di calore dall'ambiente si dice endotermica.
Energia di legame
E' l'energia necessaria per spezzare un legame , oppure : energia liberata dalla formazione di un legame . Si esprime in Kcal/mole; ad esempio, l'energia del legame H-H è uguale a 104 Kcal /mole.
Quando si forma una mole di H2 da due moli di atomi di H singoli , 6,02·1023 legami H-H , vengono liberate dal sistema all'ambiente 104 Kcal.
La esotermicità o la endotermicità di una reazione chimica va ricercata nei processi che si verificano a livello molecolare durante la reazione , ed esattamente:
-
Rottura dei legami chimici nelle molecole dei reagenti ;
-
Formazione di nuovi legami chimici tra gli atomi nei prodotti di reazione.
Per spezzare i legami tra gli atomi dei reagenti occorre fornire energia (processo endotermico), mentre quando si formano i nuovi legami tra gli atomi che costituiscono i prodotti di reazione si libera energia (processo esotermico) .
Se l'energia per rompere i legami tra gli atomi dei reagenti è maggiore dell'energia liberata dalla formazione dei legami nei prodotti , la reazione è endotermica ; mentre se è maggiore l'energia liberata dalla formazione dei legami nei prodotti rispetto all'energia per spezzare i legami nei reagenti , la reazione è esotermica.
Primo principio della termodinamica
La variazione di energia interna , DE , di un sistema in seguito a una trasformazione è uguale al calore assorbito dal sistema , Q , meno il lavoro compiuto dal sistema, W
A "Q" è dato il segno positivo se il calore fluisce verso il sistema , e segno negativo se è il sistema a cedere calore all'ambiente. Al lavoro "W" viene dato il segno positivo se il sistema compie lavoro, e viene dato segno negativo se è l'ambiente a compiere lavoro sul sistema.
Se il lavoro scambiato dal sistema è solo meccanico, e cioè del tipo P·DV , dalla relazione precedente otteniamo : DE = Q - P·DV.
Se la reazione viene condotta in un recipiente chiuso , DV=0 ( volume costante ) , dalla precedente risulta : DE=Q (v).
Il calore svolto da una trasformazione chimica , a volume costante, si identifica con la variazione di una funzione di stato : l'energia interna: DE = E prodotti - E reagenti.
Se un sistema durante una reazione chimica , assorbe energia dall'ambiente, la sua energia finale è più grande di quella iniziale e DE risulta positivo .
Se cede energia all'ambiente DE risulta negativo .
Funzione di stato
La variazione di una funzione di stato da uno stato iniziale (1) ad uno stato finale (2) non dipende dai valori intermedi assunti dalla variabile , ovvero non dipende dal cammino percorso dal sistema , ma dipende esclusivamente dai valori assunti dalla variabile nello stato finale e nello stato iniziale .
Entalpia
Dato che la maggior parte delle reazioni chimiche avviene a pressione costante , pressione atmosferica, in termodinamica è stata introdotta una grandezza chiamata entalpia, definita come:
H = E + P·V.Se consideriamo solo trasformazioni a pressione costante, nelle quali il volume, passando dai reagenti ai prodotti cambia , la variazione di entalpia diverrà : DH = DE + P·DV .
Sapendo che DE è dato da : DE = Q - W e che per una trasformazione a pressione costante, in cui si verifica una variazione di di volume , il sistema compie un lavoro "P - V" corrispondente a P·DV, otteniamo : DE = Q - P·DV se sostituiamo l'espressione del DE nella formula relativa al DH otteniamo : DH = Q - P·DV + P·DV che semplificata ci dà : DH = Qp .
Questa equazione dice semplicemente che il calore di reazione misurato a pressione costante, Qp , è uguale al DH della reazione .
In una reazione condotta a pressione costante la variazione di entalpia è data da:
Anche l'entalpia è una funzione di stato e quindi la quantità di calore scambiata (svolto o assorbito) da una reazione condotta a pressione costante è indipendente dalle eventuali reazioni o passaggi intermedi, ma dipende soltanto dallo stato iniziale (entalpia dei reagenti) e dallo stato finale (entalpia dei prodotti) .
Poiché la determinazione del calore svolto da una reazione viene in genere effettuata per mezzo del calorimetro "bomba calorimetrica" e cioè in un recipiente chiuso (volume costante) il calore messo in gioco da una reazione si identifica in questo caso con il DE :
DE = Q(v) .Noto DE per le reazioni in cui sono presenti delle sostanze in fase gassosa , si può facilmente calcolare il DH :
Applicando a ciascun gas l'equazione dei gas perfetti PV = nRT risulta D(PV) = Dn(RT).
Sostituendo : DH = DE + Dn(RT) .
Il termine Dn si ottiene sottraendo dalla somma delle moli totali dei prodotti di reazione , la somma delle moli totali dei reagenti, tenendo conto soltanto delle moli delle sostanze allo stato gassoso.
Reazione esotermica a pressione costante
Conducendo la reazione in un cilindro munito di un pistone mobile , quando si forma una sostanza gassosa , o aumenta il numero di moli di sostanze allo stato gassoso nei prodotti di reazione , il pistone verrà spinto contro la pressione atmosferica e all'interno del sistema la pressione rimarrà costante .
Ma il gas, muovendo il pistone, compie lavoro, e l'energia necessaria proviene dall'energia totale ceduta dalla reazione .
Quindi la quantità di energia ceduta come calore di reazione a pressione costante (DH) , è minore dell'energia ceduta dalla reazione (DE) , poiché una parte di questa viene utilizzata per compiere il lavoro di espansione : P·DV = Dn (RT) .
| -DH = -DE + P·DV | E : negativa perché ceduta dal sistema |
| DH : negativa perché ceduta dal sistema | |
| P · DV : positivo perché fatto dal sistema |
Se durante una reazione chimica esotermica un sistema si espande contro la pressione costante dell'atmosfera il DH della reazione risulta , in valore assoluto , leggermente inferiore al DE.
Se durante la reazione il sistema si contrae , contro la pressione costante dell'atmosfera , (diminuzione del numero di moli allo stato gassoso ) il DH di reazione risulta , in valore assoluto, leggermente superiore del DE. ( vedi esempi numerici ).
Se una reazione avviene senza alcuna variazione del numero di moli delle sostanze gassose , o tra sostanze in soluzione e allo stato solido DH = DE , per le specie chimiche allo stato liquido e allo stato solido entalpia ed energia interna si possono identificare , ne consegue Q (p) = Q (v).
Calcolare a 25°C il DH° della reazione di formazione di una mole di anidride solforica (P = 1 atm) a partire dai suoi elementi nei rispettivi stati standard , essendo noto che alla medesima temperatura la reazione:
S(s) + 3/2 O2 (g) -----> SO3 (g)
essa, condotta in una bomba calorimetrica ( volume costante) , sviluppa 94,15 Kcal per ogni mole di SO3 che si forma .
| DE° = - 94,15 Kcal /mole | Dn = 1 - 3/2 = -1/2 | T = 298 K |
Applicando l'equazione DH° = DE° + Dn(RT) e sostituendovi i dati otteniamo:
DH° = - 94,15 - (1/2 × 1,98 × 298 × 10-3 ) = - 94,45 Kcal/ mole
( R = 0,0821 litri × atm × mole-1 × grado-1 , R = 1,987 calorie × moli-1 × grado-1 )
Per esempio la reazione :
CO(g) + ½ O2 (g) -----> CO2 (g)
DH = - 67344 cal /mole Dn(RT) = ( 1- 1,5 ) RT = 0,5
RT = 0,5 × 1,987 × 298 = - 296 cal / mole
DH = DE + DnRT
si ha perciò :
- 67640 = DE + (- 296 ) DE = - 67344 cal / mole.
In entrambi gli esempi l'energia svolta a pressione costante è maggiore di quella svolta a volume costante , perché i processi avvengono con riduzione del numero di moli dei componenti gassosi.
Mentre l'energia interna di un sistema è una funzione di stato , altrettanto non può essere detto in generale per il calore (Q) e per il lavoro (W) scambiati dal sistema quando essi vengono considerati separatamente .
Infatti si può dimostrare che il loro valore numerico è , in genere diverso , in dipendenza del "cammino percorso" dal sistema durante la trasformazione . Il calore scambiato , svolto o assorbito , a pressione costante Q(p) si identifica con la variazione di una funzione di stato , l'entalpia , e pertanto il suo valore è indipendente dalle eventuali reazioni intermedie , ma dipende solo dallo stato iniziale (entalpia dei reagenti) e dallo stato finale (entalpia dei prodotti). Le stesse considerazioni valgono per Q(v).
Note di termochimica : Legge di Hess
Il calore scambiato in una reazione che si svolge a pressione costante Q(p) , o a volume costante Q(v) , è indipendente dalle eventuali reazioni intermedie , ma dipende solo dallo stato iniziale e finale del sistema chimico , e cioè dall'entalpia o dall'energia interna dei reagenti e dei prodotti della reazione .
In termochimica è abitudine assumere come protagonista l'esterno , per cui si fa precedere dal segno positivo il calore svolto nella reazione e dal segno negativo quello assorbito .
Per esempio la reazione
| Cs + O2 (g) ----> CO2 (g) | DH = 94 Kcal / mole |
Invece in termochimica il calore svolto nella reazione verrà così indicato Qp = + 94 Kcal / mole.
La reazione di combustione del carbonio di cui sopra può essere scomposta in due fasi distinte con la formazione intermedia dell'ossido di carbonio:
| Cs + ½O2 (g) ----> CO(g) | DH = -27 Kcal / mole |
| COg + ½O2 (g) ---->CO2 (g) | DH = -67 Kcal / mole |
Sommando membro a membro le equazioni stechiometriche delle due reazioni si ottiene l'equazione della reazione di combustione completa del carbonio .
Anche la somma delle entalpie delle singole reazioni corrisponde all'entalpia della reazione di combustione completa a CO2.
| Cs + O2 (g) ----> CO2 (g) | DH = 94 Kcal / mole |
Ciò concorda col fatto che l'entalpia è una funzione di stato del sistema , e quando, in due percorsi diversi , lo stato iniziale e quello finale coincidono , anche la variazione di entalpia sarà la stessa.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |