 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
La dissociazione ionica
(del prof.Augusto Biasotti)
La dissociazione ionica degli ossiacidi
Prendiamo in considerazione l'acido solforico, H2SO4
. Nella molecola i due atomi di H sono legati a due
atomi di ossigeno con un legame di tipo covalente fortemente
polarizzato.
In soluzione acquosa le molecole polari dell'acqua favoriscono la
rottura di tale legame in prossimità dell'atomo di H lasciando la
coppia di elettroni di legame (un elettrone proveniente dall'atomo
di idrogeno e l'altro dall'atomo di ossigeno) all'atomo di ossigeno
che è più elettronegativo.
I due atomi di H che si staccano, dato che ognuno ha perso un elettrone, assumono una carica positiva,
si formano due ioni H+ .
I due atomi di O del residuo acido, dato che hanno strappato un elettrone ciascuno ai corrispondenti atomi di H, assumono una carica negativa.
Il processo può essere rappresentato con le relative formule di struttura nel seguente modo:
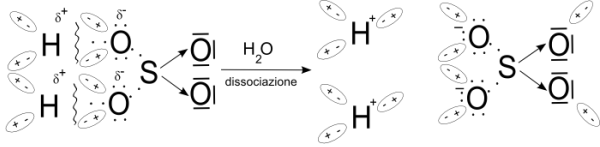
Il processo viene rappresentato in forma ionica
nel seguente modo:
H2SO4 ![]() 2H+(idrat.) + SO42-
2H+(idrat.) + SO42-
Nella rappresentazione della
dissociazione (o pi� precisamente ionizzazione) la formula del
residuo acido si scrive riportando dopo il simbolo dello zolfo i
quattro atomi di ossigeno indicando, a destra in alto, le due
cariche negative senza specificare su quali dei due atomi sono
collocate.
![]()
![]() Estendendo
agli altri ossiacidi:
Estendendo
agli altri ossiacidi:
HNO3 ![]() H+ + NO3-
; H3PO4
H+ + NO3-
; H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
I sali sono composti ionici formati da ioni positivi (cationi) e ioni negativi (anioni ) disposti in modo ordinato nel solido.
La somma algebrica delle cariche positive e
negative degli ioni riportati nella relativa formula chimica '
uguale a zero.
Quando un cristallo di un sale viene immerso in acqua, le molecole
polari del liquido interagiscono con gli ioni positivi e negativi
che si trovano sulla superficie esterna (legame ione-dipolo), li
distaccano dal cristallo e li trasportano in soluzione.
In soluzione gli ioni sono avvolti dalle molecole acqua secondo lo
schema sotto riportato (idratazione).
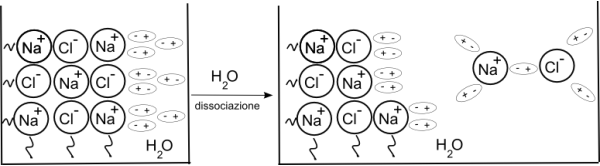
La dissociazione ionica degli idrossidi
Le basi sono composti ionici formati da ioni positivi provenienti da un metallo e lo ione negativo OH -. In acqua si dissociano secondo lo schema riportato per i sali, liberando ioni metallici positivi e ioni negativi:
NaOH ![]() Na+ + OH-
Na+ + OH-
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |