 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Determinazione dell'acidità del succo
di limone
Materiali occorrenti:
Limone - Idrossido di sodio sol. 0.1 M - Fenolftaleina sol. 1% - Buretta da
50 mL - Filtri in carta - Vetreria.
Esecuzione dell'esperienza:
Si spreme completamente un limone in un becker da 100 mL. Si filtra il
succo utilizzando un filtro rapido in carta ( ad es. filtro a banda nera o filtro Wathman 113 o 91 ), se ne prelevano, con pipetta tarata o graduata, 2 mL versandoli in una beuta
da 250 mL; si aggiungono 100 mL circa di acqua distillata e 3 o 4 gocce di fenolftaleina sol. 1% quale indicatore; la
soluzione rimane, ovviamente, incolore.
Si riempie la buretta con 50 mL di idrossido di sodio sol. 0.1 M, si pone la beuta sotto il rubinetto e si procede alla titolazione,
gocciolando lentamente il titolante ed agitando la beuta.
Al punto di viraggio al rosa-violetto dell'indicatore si chiude il rubinetto
della buretta e si annota la quantità di idrossido di sodio sol. 0.1 M
consumata.
A questo punto tutto l'acido citrico presente nel succo di limone è
stato neutralizzato dall' idrossido di sodio con la reazione:
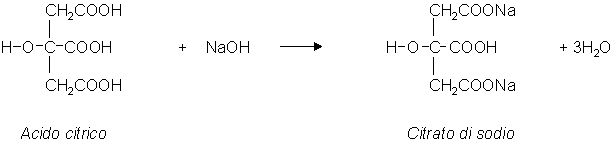
Come si vede per neutralizzare una mole di acido citrico,
idrossiacido alifatico tricarbossilico, sono necessarie 3 moli di idrossido
di sodio, per cui il numero di moli presenti nella quantità di idrossido
di sodio gocciolata è 3 volte il numero di moli di acido citrico presenti nei 2 mL di succo di limone.
Si sono utilizzati 20 mL di NaOH sol. 0.1 M per
titolare 2 mL di succo di limone; calcoliamo le moli presenti:
Con la formula: nmoli = M · VL si ha :
nmoli = 0.1 · 0.02 per cui, nmoli = 0.002
ovvero, con la proporzione V1 : M1 = V2 : Mx si ha:
| 1000 : 0.1 = 20 : x | x = 20 0.1 / 1000 | x = 0.002 |
Il valore ricavato corrisponde al numero di moli presenti nei
20 mL di idrossido di sodio sol. 0.1 M, per cui il numero di moli di acido citrico presenti in 2 mL di succo di limone è 1/3 di tale
valore, cioè nmoli = 0.00066.
Da questo valore si può risalire al titolo molare dell'acido
citrico del succo di limone con la proporzione:
| 0.00066 : 2 = x : 1000 | x = 1000 0.00066 / 2 | x = 0.33 M |
Il succo di limone è, quindi, una soluzione 0.33 M di acido citrico.
E' possibile, poi, trasformare il valore molare in concentrazione g/L moltiplicando il numero di moli per la massa molecolare
relativa dell'acido citrico ( = 192.13 ):
0.33 192.13 =
63.40 g/L
ovvero circa il 6 %.
Infatti il succo di limone contiene circa il 6 % di acido citrico e presenta una concentrazione idrogenionica circa 2 · 10 -3 M che determina un pH = 2.8.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |