Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
La Spettroscopia
Materiali occorrenti:
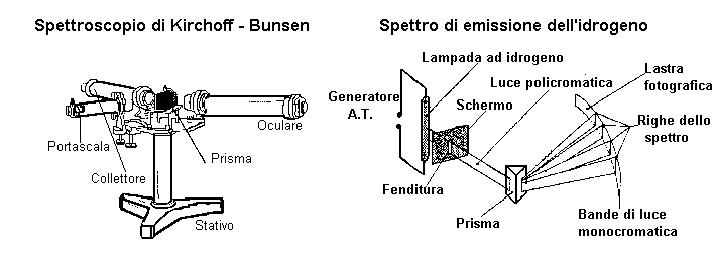
Spettroscopio a reticolo - Spettroscopio tascabile a prisma - Spettroscopio
di Kirchoff-Bunsen - Tubi di Plucher - Lampade spettrali di alcuni elementi (es.
Na, H2, Hg, He, Ar, CO2, Ne) - Alimentatore AT per tubi di Plucher (rocchetto ad induzione) -
Alimentatore per lampade spettrali - Sostegni portalampada - Cavi.
Richiami teorici:
Si ritiene necessario una breve trattazione sulla natura della luce:
Le onde:
Sono perturbazioni che si propagano in modo periodico nello spazio vuoto od
occupato da materia. A seconda del vettore di spostamento si distinguono onde
longitudinali ed onde trasversali.
Le onde periodiche sono caratterizzate dalle seguenti grandezze:
- Periodo ( T ): più piccolo intervallo di tempo nel quale
un'onda compie un'oscillazione completa ( ciclo ).
- Frequenza ( ν ): numero di cicli per
secondo. L'unità SI è l'hertz ( Hz ) = 1 ciclo/secondo. La sua espressione è = ν = 1 / T .
- Lunghezza d'onda ( λ ): distanza percorsa da un'onda in un periodo, ovvero la distanza tra due picchi
d'onda.
La sua espressione è = T. L'unità di misura SI è il metro ( m ) con i suoi sottomultipli.
- Ampiezza: massimo spostamento che rispetto alla posizione di riposo
subisce un punto qualsiasi dell'onda.
Onde elettromagnetiche:
Onde trasversali che si propagano in un campo elettromagnetico; il campo elettrico ed il campo magnetico sono ortogonali tra di loro e
perpendicolari alla direzione di propagazione dell'onda.
La luce come fenomeno ondulatorio:
La luce è una radiazione elettromagnetica di natura ondulatoria; può essere considerata anche come energia elettromagnetica, trasferita attraverso lo spazio o la materia per mezzo di onde.
La velocità della radiazione elettromagnetica è una costante detta velocità
della luce, c= 3.00 · 108 m/s, data dal prodotto della lunghezza d'onda per la frequenza: c = λ · ν, da cui deriva anche λ = c / ν. Tutte le radiazioni elettromagnetiche viaggiano nel vuoto a
velocità = c.
Spettro elettromagnetico:
La radiazione elettromagnetica comprende una vasta gamma di frequenze che
costituiscono lo spettro elettromagnetico che è costituto da diversi tipi
di radiazioni, certe a frequenza molto bassa come le onde radio ( 104 ÷ 1011 Hz ) e le microonde ( 108 ÷ 1012 Hz ), altre a frequenza molto alta come i raggi X o i raggi gamma ( < 1017 Hz ). Solo una piccola parte dello spettro, compresa tra 4.3 · 1014 e 7 · 1014 Hz può essere percepita dall'occhio umano; questa radiazione è detta spettro
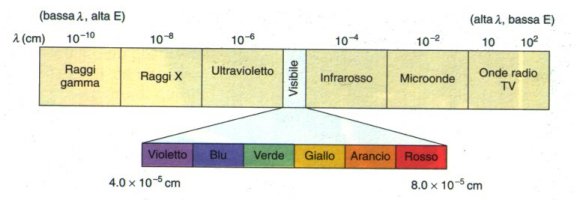
visibile ed è costituita dalla serie dei colori che, dalla frequenza più bassa,
sono il rosso, l' arancio, il giallo, il verde, il blu ed il violetto. L'insieme dei colori forma la luce bianca. Le
frequenze prima del rosso, con = 3 · 1014 Hz costituiscono l'infrarosso; quelle oltre il violetto, con = 10
· 1014 Hz sono dette ultravioletto.
Considerata la relazione λ = c / ν è facile comprendere che le
lunghezze d'onda diminuiscono all'aumentare delle frequenze. Le lunghezze d'onda
dello spettro visibile sono: rosso = 700 nm, arancio = 620 nm, giallo = 580 nm, verde = 530 nm, blu = 470 nm, violetto = 420 nm
( 1 nm = 1 · 10 -9 m ).
Spettro della luce
La luce come fenomeno corpuscolare:
Max Planck con la meccanica quantistica aggiunge al concetto ondulatorio quello di radiazione elettromagnetica intesa come un flusso di particelle dette fotoni. I fotoni sono dei quanti di energia che viaggiano alla velocità della luce e possiedono una frequenza . L'energia di una radiazione è proporzionale alla frequenza: E = h , ove h è una costante ( costante di Planck ) = 6.63 · 10 -34 Js.
Spettri atomici:
Sono l'insieme delle radiazioni elettromagnetiche emesse da una sostanza; si
dividono in:
Spettri di emissione continui o discreti: sono emessi da una sorgente
luminosa; presentano tutti i colori dal rosso al violetto sfumati l'uno
nell'altro. Sono emessi da corpi incandescenti, solidi, liquidi o gassosi,
fortemente compressi; sono esempi lo spettro solare e quello emesso da una
lampada ad incandescenza.
Spettri di emissione a righe: presentano righe colorate su sfondo
nero; sono emessi da sostanze gassose o rese gassose a bassa pressione. Ogni
spettro è caratteristico di ogni sostanza.
Spettri di assorbimento: se un gas o una sostanza resa gassosa che si
trova a temperatura inferiore a quella di una sorgente di luce bianca, è
interposto tra detta sorgente ed uno spettroscopio si ottiene uno spettro di
assorbimento; esso è caratterizzato da uno sfondo colorato continuo e dalle
righe di assorbimento. Per una stessa sostanza le righe di assorbimento sono
sovrapponibili, ovvero hanno la stessa lunghezza d'onda delle righe colorate
dello spettro di emissione.
Le frequenze della radiazione che può emettere un' atomo di un elemento
quando viene eccitato sono uniche per cui ogni elemento possiede uno spettro
caratteristico formato da ben definite righe; in altre parole per ogni atomo
sono possibili solo caratteristiche variazioni di energia.
La spettroscopia:
Applicando una tensione elevata ad un tubo di scarica contenente un gas rarefatto oppure vapori di metalli, si ha una emissione di energia radiante percepita dall'occhio umano sotto forma di una luce con colore caratteristico.
All'esame spettroscopico si può scomporre tale luce nel corrispondente spettro di emissione.
Ad esempio, sottoponendo alla scarica un tubo o una lampada contenente idrogeno rarefatto, un gran numero di atomi viene eccitato. L'elettrone di ogni atomo prima dell'eccitazione si trovava allo stato fondamentale ( o livello energetico ) n=1, ovvero in posizione più vicina al nucleo; in seguito alla somministrazione di energia l'elettrone passa a un livello energetico superiore. La lettera n indica il numero quantico principale che definisce, appunto, il livello energetico ove si trova l'elettrone.
In non tutti i casi, però, l'elettrone passa allo stesso livello energetico
superiore: in molti salta a n=2, in altri salta a n=3 e così via.
Al termine dell'eccitazione l'elettrone ritorna allo stato fondamentale n=1 restituendo l'energia che gli era stata fornita sotto forma di radiazione luminosa.
Poichè i percorsi di ritorno dagli stati eccitati ( n=2, n=3, etc.) hanno percorsi diversi, si ha una contemporanea emissione di diverse frequenze.
L'insieme di queste frequenze formano lo spettro di emissione caratteristico
dell'atomo di idrogeno ( atomo di Bohr ).
Il modello di Bohr riusciva a spiegare abbastanza bene lo spettro di emissione dell'idrogeno; per atomi con più di un elettrone si osservavano delle righe formate da " multipletti " ovvero righe secondarie molto vicine tra loro. La differenza di frequenza tra le righe secondarie è molto piccola per cui è possibile che, ad esempio, tra lo stato fondamentale e lo stato eccitato n = 2 siano possibili diverse transizioni rilevabili dalle righe secondarie dello spettro.
Sommerfeld propose allora una teoria in cui sostituiva le orbite
circolari di Bohr, definite solo dal parametro raggio, con orbite ellittiche definite da due parametri, ad es. gli assi, di cui il nucleo occupa uno dei
fuochi. Anche questo sistema, al pari di quello di Bohr, è quantizzato,
per cui Sommerfeld definì un secondo numero quantico, il numero quantico
angolare ( l ) che determina la " quantizzazione dell'eccentricità
dell'ellisse " che l'elettrone può percorrere nei suoi stati stazionari. In
altre parole il numero quantico angolare definisce la forma dell'orbitale ; esso può assumere, per ogni valore di n i valori interi compresi tra 0 e n-1. Di conseguenza ogni livello energetico è formato da più sottolivelli che differiscono per piccole quantità di energia. In questo
modo aumentano i salti energetici possibili per gli elettroni.
Ad es. per un elettrone in cui n=2 l può assumere i valori di 0 e 1 e a questi valori corrispondono due orbite: n=2 e l=0 e n=2 e l=1.
Queste orbite sono lievemente differenti per forma e valori di energia.
In questo modo è possibile interpretare i raggruppamenti di linee vicine
negli spettri:
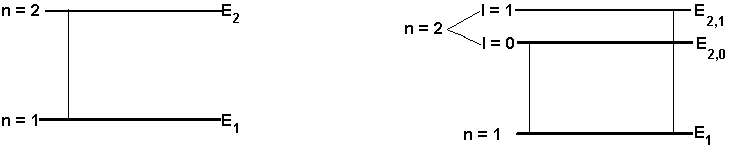
Per certi gruppi di righe quanto sopra esposto è, però, insufficiente, come ad es. per spettri di atomi eccitati e sottoposti a campi magnetici esterni ( effetto Zeeman ).
Per questo motivo si ipotizzò che un elettrone percorrendo la sua orbita generasse un campo magnetico, per cui fu introdotto il numero quantico magnetico ( m ) che può assumere i valori di 0, 1, 2, 3, ...., ± l.
In ultimo, altri particolari sdoppiamenti delle righe spettrali fecero
pensare che l'elettrone nella sua orbita ruotasse anche sul proprio asse, in
senso orario ed antiorario, generando un altro campo magnetico. Perciò fu
introdotto il numero quantico magnetico di spin ( ms ), che può assumere valori di +½ e -½ .
In assenza di campo magnetico esterno solo i valori di n e l determinano i valori energetici degli elettroni dell'atomo.
In presenza di un campo magnetico esterno anche i numeri quantici m e ms influenzano relativamente i valori delle energie,
causando gli sdoppiamenti delle righe.
Il modello di Bohr - Sommerfeld non riesce però a spiegare molti fenomeni
fisici, tra i quali gli spettri a righe di elementi con più elettroni per cui lo
stesso è superato dal modello ad orbitali introdotto dalla meccanica quantistica. Per una trattazione di questo si rimanda ai vari
testi di chimica e chimica-fisica.
Esecuzione dell'esperienza:
Parte prima: osservazione di tubi di Plucher con spettroscopio a reticolo:
Si pone un tubo di Plucher con sodio nell'apposito sostegno, si collegano i due poli con l'alimentatore AT e si dispone il tubo davanti alla fenditura dello spettroscopio.
Si oscura l'aula e si accende l'alimentatore; dopo pochi secondi di riscaldamento si procede all'osservazione dello spettro attraverso il reticolo di rifrazione. Detto reticolo è montato su un cursore scorrevole lungo il banco ottico. Si dovrebbero osservare due righe gialle sullo schermo ai due lati della fenditura; queste righe servono per la taratura dello strumento: infatti, spostando in avanti o indietro il reticolo è possibile posizionare le righe sui valori relativi indicati sulla scala e corrispondenti al simbolo Na ( ca.5800 Å )
Dopo la taratura si procede all'osservazione delle radiazioni emesse da altri
tubi e all'analisi degli spettri delle sostanze in essi contenuti.
Parte seconda: osservazione di lampade spettrali con spettroscopio di Kirchoff-Bunsen:
Si monta lo spettroscopio davanti al supporto per le lampade spettrali, ovviamente collegando lo stesso al relativo alimentatore. Si pone un proiettore diottrico di fronte al tubo per la scala graduata. Anche in questo caso preferibile, al fine di operare una buona taratura dello strumento, procedere all'osservazione della lampada al sodio.
Si oscura l'aula, si accendono gli alimentatori, si lascia riscaldare la lampada per alcuni secondi. Si pone, a questo punto, l'occhio sull'oculare muovendolo fino a che non sia visibile uno spettro. A questo punto si adatta il cannocchiale al proprio visus e si regola la fenditura posta sul collimatore fino a che non siano evidenti due righe gialle molto ravvicinate ( doppietto ).
Si chiude il prisma mobile per la scala graduata e si muove l'oculare fino a posizionare le righe gialle su una lunghezza d'onda pari a ca. 5800 Å.
Lo strumento è tarato ed è possibile procedere all'osservazione degli spettri
emessi dalle lampade disponibili.
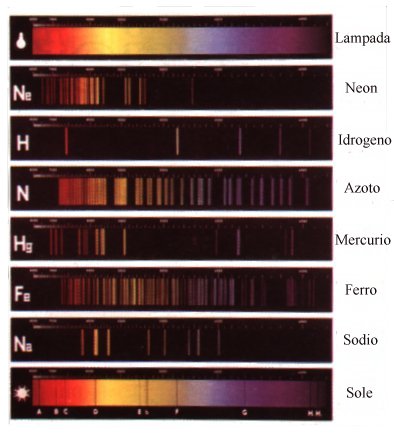
Spettri di emissione
Parte terza: osservazione dello spettro continuo della luce solare:
Si utilizza lo spettroscopio tascabile a prisma. Si apre convenientemente la fenditura dello spettroscopio, si adatta l'oculare al proprio visus e si punta verso la luce solare.
Quando la luce solare passa attraverso il prisma si scompone nello spettro
continuo formato dalle radiazioni colorate che vanno dal viola ( ca.4000 Å ) al rosso
( ca.7500 Å ) evidenziando i colori principali.
Questo spettro è detto continuo in quanto non presenta zone d'ombra.
Uno spettro continuo può essere anche osservato da una lampada
ad incandescenza.

Spettro continuo
Nota: data la presenza di alimentatori ad alta tensione, si richiede
la massima cautela nel montare le apparecchiature e nell'esecuzione delle
esperienze. Gli spettri evidenti risultano quelli emessi da lampade contenenti
gas nobili.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |