 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Preparazione del cloro
Materiali occorrenti:
Permanganato di potassio - Bicromato di potassio - Acido cloridrico sol. 37 %
- Vetreria.
Esecuzione dell'esperienza:
Si basa su due reazioni di ossidoriduzione molto simili, nelle quali si ha
ossidazione dello ione Cl - ad opera di due energici ossidanti quali il permanganato di
potassio ed il bicromato di potassio in soluzione acida.
Si preparano due provette con 5 o 6 mL di acqua distillata; in una si aggiunge una punta di spatoletta di bicromato di
potassio; nell'altra altrettanto permanganato di potassio.
Nella prima provetta si fanno gocciolare con una pipetta 5 mL
circa di acido cloridrico sol. 37 % . Si osserva il cambiamento del
colore arancio, tipico delle soluzioni di Cr6+ al
colore giallo-verde delle soluzioni di Cr3+;
contemporaneamente si ha sviluppo di cloro, un gas dall'odore pungente
che, a causa della densità circa 2.5 volte maggiore di quella dell'aria, non
tende a fuoriuscire dalla provetta.
La reazione redox che avviene è la seguente:
K2Cr2O7 + 8HCl + 6HCl -----> 2KCl + 2CrCl3 + 3Cl2 � + 7H2O
ovvero, in forma ionica:
| ossidazione | 6Cl- -------> 3Cl2 + 6e |
| riduzione | Cr2O72- + 6e + 14H+ -------> 2Cr3+ + 7H2O |
| ------------------------------------------------------------------------------ | |
| 6Cl- + Cr2O72- + 14H+ -------> 3Cl2 + 2Cr3+ + 7H2O |
Allo stesso modo si fanno gocciolare 5 mL circa di acido
cloridrico sol. 37 % nella seconda provetta; si osserva il cambiamento del
colore viola intenso, tipico delle soluzioni dello ione Mn7+ al quasi incolore delle soluzioni di Mn2+. Analogamente
alla reazione precedente si ha sviluppo di cloro, nei modi e con le
caratteristiche già descritte.
La reazione è la seguente:
2KMnO4 + 6HCl + 10HCl -------> 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O
ovvero, in forma ionica:
| ossidazione | 10Cl- -------> 5Cl2 + 10e |
| riduzione | 2MnO4- + 10e + 16H+ -------> 2Mn2+ + 8H2O |
| ------------------------------------------------ | |
| 10Cl- + 2MnO4- + 16H+ -------> 5Cl2 + 2Mn2+ + 8H2O |
Nota operativa: per un buon risultato dell'esperienza è
necessario che le soluzioni preparate non siano troppo concentrate. E'
sufficiente, quindi, sciogliere pochissimo sale in acqua.
Lo sviluppo di cloro non è, di norma, massivo.
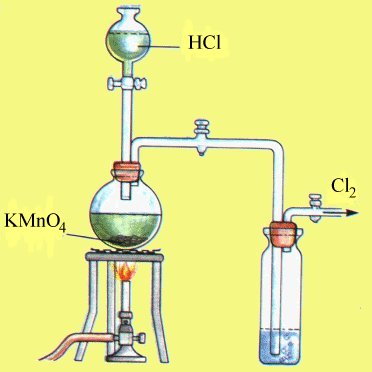
Nella figura è riportato un completo sistema per lo sviluppo e la raccolta del cloro, utilizzando la seconda reazione:
Sommario
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |