 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
La legge isocora dei gas ( legge di
Charles )
Materiali occorrenti:
Apparecchio per la legge di Charles - Mercurio 500 g. - Becker da 800 mL -
Termometro - Piastra riscaldante elettrica - Barometro - Vetreria.
Richiami teorici:
Jacques Charles nel 1787, dopo aver effettuato numerosi esperimenti,
dichiarò che " riscaldando un gas a volume costante si provoca un aumento
della pressione; per ogni grado centigrado di temperatura la pressione aumenta
di 1/273 della pressione che il gas esercitava a 0 °C " ovvero:
P0 = Pt (1+ at ) ove P0 = pressione a 0 °C, Pt = pressione a t °C, a=1/273.
Esecuzione dell'esperienza:
Si rileva preliminarmente la pressione atmosferica, utilizzando il barometro, e se ne trascrive il valore nella tavola di esercitazione,
considerandola costante per tutte le letture.
Si versa nel becker acqua fredda, possibilmente con alcuni cubetti di
ghiaccio, fino a 3-4 cm dal bordo e si immerge l'apparecchio, fissandolo con il
sostegno a pinza e controllando che tutto il pallone in vetro risulti immerso.
Il volume dell'aria imprigionata nel pallone viene considerata costante in ogni
fase.
Si pone l'apparecchio sull'elemento riscaldante ancora spento e si versa il
mercurio, con l'aiuto di un imbutino, nel ramo di destra del tubo ad U, fino a
che il livello non raggiunga, perfettamente, lo zero della scala.
A questo punto si chiude il ramo di sinistra con un tappino, si immergono il
termometro e l'agitatore attraverso i due fori posti sulla base e si inizia a
rilevare i valori di temperatura.
Il primo valore rilevato serve per la prima lettura, alla quale si assegna un dislivello = 0 e, quindi, una pressione sull'aria contenuta nel
palloncino, pari alla sola pressione atmosferica. Si trascrive il valore sulla
tabella dei dati.
Si inizia il riscaldamento della massa d'acqua e, di conseguenza, anche
dell'aria contenuta nel palloncino, agitando in modo da avere omogeneità in
tutti i punti. Ad intervalli regolari di temperatura, ad esempio ogni 5 °C, si
rilevano i dislivelli esistenti tra i menischi dei due rami del tubo ad U,
indicanti l'aumento della pressione, riportando tali valori sulla tabella di
esercitazione. Al fine di limitare possibili errori sperimentali si effettuano,
in totale, 8/10 letture.
Al termine della rilevazione dei dati, dopo aver spento l'elemento
riscaldante, si procederà alla graficazione cartesiana di tali valori.
In un piano cartesiano, di dimensioni adeguate, si pongono le temperature in °C nell'asse delle ascisse e i valori delle pressioni in mm di Hg nell'asse delle ordinate.
Il risultato sarà il grafico di una funzione del tipo y = a + b · x ,
ovvero una retta che interseca l'asse delle ordinate in un punto a .
Con i valori rilevati nell'esperienza è anche possibile estrapolare lo zero assoluto ( -273.16 °C ), punto limite ove la pressione
teoricamente si annulla.
Grafico sperimentale della legge isocora dei gas
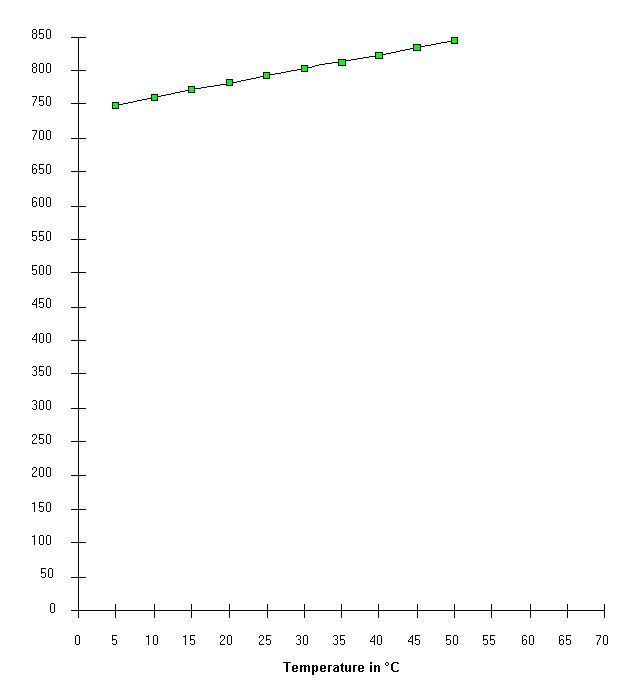
Tavola dei risultati
| Letture | Temperature in °C | Dislivello (dv) in mmHg | Press.atm. (pa) in mmHg | Press. aria in mmHg(dv+pa) |
| 1 | 5 | 0 | 748 | 748 |
| 2 | 10 | 11 | 748 | 759 |
| 3 | 15 | 23 | 748 | 771 |
| 4 | 20 | 33 | 748 | 781 |
| 5 | 25 | 44 | 748 | 792 |
| 6 | 30 | 55 | 748 | 803 |
| 7 | 35 | 65 | 748 | 812 |
| 8 | 40 | 75 | 748 | 823 |
| 9 | 45 | 87 | 748 | 835 |
| 10 | 50 | 97 | 748 | 845 |
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |