 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Gli esteri
Materiali occorrenti:
Acido acetico glac. - Etanolo 95 % - Olio di oliva ( o di semi ) - Idrossido
di sodio sol. 8 M - Cloruro di sodio crist. - Acido solforico sol. 95 % - Sapone
di Marsiglia - Vetreria .
Richiami teorici:
Gli esteri sono composti derivati dalla reazione di un acido carbossilico ed un alcool con eliminazione di acqua, secondo la reazione generica:
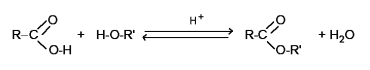
Nel gruppo caratteristico, detto alcossilico, O-R' il radicale può essere di tipo alifatico o aromatico.
Gli esteri a basso P.M. sono molto volatili ed hanno odori
caratteristici, spesso simili a quelli di vari frutti. Sono composti molecolari
pochissimo solubili in acqua e solubili nei composti apolari.
Se la reazione di formazione avviene tra un acido carbossilico con numero di atomo di carbonio da 12 a 22 e il glicerolo (1,2,3-propatriolo) si ottiene un trigliceride :
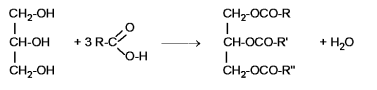
Se a reagire è un acido carbossilico saturo ( es. laurico, palmitico, stearico ) il trigliceride è solido e si dice grasso.
Se a reagire è un acido carbossilico insaturo ( es. linoleico, linolenico, oleico ) il trigliceride è liquido e si dice olio.
Di norma grassi e olii contengono diversi acidi carbossilici.
Esecuzione dell'esperienza:
Parte prima: sintesi dell'acetato di etile ( etanoato di etile ):
La reazione di sintesi di un estere p abbastanza lenta e richiede alte
temperature. E' perciò necessario utilizzare un sistema di riscaldamento formato
da un pallone e da un " refrigerante a ricadere " al fine di evitare
l'evaporazione dei reagenti.
In un pallone in vetro pyrex da 250 ml. si versano 20 mL di acido acetico
glaciale e 20 mL di alcool etilico 95°; si mescola e si aggiungono, goccia a
goccia,
10 mL di acido solforico sol. 95 % . Si monta il refrigerante e si
riscalda lentamente per circa 10 minuti.
A reazione avvenuta si lascia raffreddare e dopo 10 minuti si aggiungono 100 mL circa di acqua distillata. L'estere formatosi, l'etanoato di etile, avendo densità minore ed essendo insolubile, galleggerà sull' acqua. L'eccesso di acido può essere eliminato con agitazione in una soluzione al 10 % di carbonato di sodio e l'estere essere separato attraverso un imbuto separatore. La reazione avvenuta è:
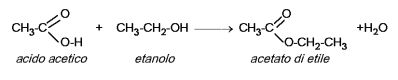
Parte seconda: reazione di idrolisi di un trigliceride ( reazione di saponificazione ):
La reazione di un trigliceride con una soluzione di idrossido di sodio ( o di potassio ) porta alla formazione di un sale sodico ( o potassico ) di un acido grasso. Tale prodotto è un sapone. I saponi sono
duri quando si tratta di sali sodici e molli quando si tratta di sali potassici.
In un becker da 100/200 ml. si versano 10 mL di olio di oliva ( o di semi ) e 5 mL di idrossido di sodio sol. 8 M. Si aggiungono 10 mL di acqua distillata e si porta il becker su una reticella amiantata posta su un bunsen, procedendo ad un lento e cauto riscaldamento. Si agita frequentemente, aggiungendo acqua se questa evapora, fino a che la saponificazione non si è completata. Quando si osserva la comparsa di schiuma e la completa assenza di gocce di olio, si aggiunge una spatolata di cloruro di sodio crist. al fine di favorire l'aggregarsi del sapone in micelle. Si lascia raffreddare e si recupera il sapone formatosi. Da notare che il prodotto è notevolmente alcalino.
La reazione avvenuta è:
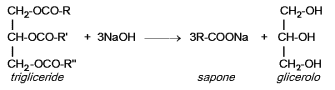
Parte terza: esame del potere detergente dei saponi:
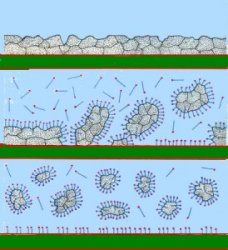
L'azione detergente del sapone è determinata dalla struttura molecolare dello stesso in cui esiste una parte lipofila apolare (coda) ed una parte idrofila polare (testa):

Lo sporco grasso viene aggredito dalle code lipofile e ridotto
in particelle ove le stesse code affondano; le particelle sono disperse
nell'acqua per mezzo delle teste idrofili. L'azione meccanica porta al completo
distacco dello sporco.
Per verificare l'azione detergente del sapone, si preparano due provette contenenti ciascuna 5 mL di acqua distillata e 5/10 gocce di olio. In una delle due provette si aggiunge una piccola quantità di sapone di Marsiglia (o del sapone precedentemente preparato). Si agitano entrambe le provette e si nota che nella prima provetta, quella senza il sapone, si ha stratificazione dell'olio sull'acqua, mentre nella seconda provetta, quella contenente il sapone, si ha una omogenea dispersione delle particelle del grasso nell'acqua.
Le proprietà detergenti dipendono, quindi, dalla capacità del sapone di formare emulsioni in cui le molecole del sapone stesso "racchiudono" le particelle di sporco in un involucro solubile in acqua che ne permette la dispersione.
Sommario
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |