 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
L'elettrolisi di una soluzione di
ioduro di potassio
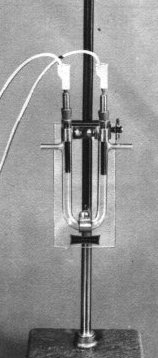
Materiali occorrenti:
Tubo ad U con tubicini laterali - Sostegno - Ioduro di potassio sol. 0.1 M -
Fenolftaleina sol. 1 % - Salda d'amido - Generatore c.c. 6 volts - Elettrodi in
grafite o in Ni-Cr montati su tappi in gomma - Cavi.
Esecuzione dell'esperienza:
Si versa la soluzione di ioduro di potassio nel tubo ad U fino ad un livello sufficiente per l'immersione degli elettrodi.
Si inseriscono gli stessi nei due fori del tubo collegandoli al generatore di
c.c., indicando l'anodo ( + ) e il catodo ( - ).
Nella soluzione, prima dell'elettrolisi, sono presenti molecole di H2O e gli ioni: K+ e I - provenienti dalla dissociazione del sale. Si trascura la presenza di ioni H3O+ ed OH - provenienti dall'autoionizzazione di H2O.
Chiudendo il circuito l'anodo richiama a sè gli anioni I - e molecole di H2O,
mentre il catodo richiama a sè i cationi K+ e
molecole di H2O. Le
molecole di acqua sono, come noto, dipoli per cui possono migrare ad entrambi gli elettrodi.
Avvengono le seguenti reazioni di ossidoriduzione:
Catodo: si sviluppano bollicine di gas idrogeno formatosi dalla reazione di riduzione dell'acqua:
2H2O
+ 2e ----> H2 ↑ + 2OH -.
Non si ha la contemporanea riduzione di K+ a potassio elementare in quanto il potenziale standard di questo è: E0(
K+ / K ) = -2.91 v , valore che indica una tendenza ad acquistare elettroni, ovvero a
ridursi, minore di quella dell' acqua
( E0( H2O / H2 ) = - 0.83 v ).
Si preleva una parte della soluzione catodica attraverso il
tubicino ponendola in una provetta; aggiungendo alcune gocce di fenolftaleina si noterà un pH basico dovuto all'aumento della concentrazione di OH - prodottosi nella reazione di riduzione.
Anodo: si osserva un lento depositarsi di iodio per la reazione di ossidazione :
2I - ----> I2 + 2e
Solo lo ione I- subisce l'ossidazione; il suo
potenziale standard ( E0( 2I - / I2 ) = +0.536 v ) è, infatti, minore di quello di H2O
( E0( O2/H2O ) = +1.23 v ) ; questo significa
che I - ha una maggiore tendenza a cedere elettroni,
ovvero ad ossidarsi, di quella di
H2O.
La reazione complessiva è:
| ossidazione | 2I - ----> I2 + 2e |
| riduzione | 2H2O + 2e ----> H2 ↑ + 2OH - |
| ---------------------------------------- | |
| 2I - + 2H2O ----> I2 + H2 ↑ + 2OH - |
La presenza dello iodio può essere
rilevata con alcune gocce di tetracloruro di carbonio o benzene che si coloreranno in violetto o con alcune gocce di salda d'amido che
darà una colorazione blu.
Sommario
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |