 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
La pila Daniell
Materiali occorrenti:
Lamine di rame, zinco, magnesio - Soluzioni 0.1 M di solfato
di rame II, solfato di zinco, solfato di magnesio - Soluzione
concentrata di cloruro di ammonio - Voltmetro - Tester - Cavi di
collegamento - Vetreria.
Richiami teorici:
Le ossidoriduzioni consistono in un flusso di elettroni
dall'elemento meno elettronegativo a quello più elettronegativo;
tale flusso altro non è che energia elettrica. Se teniamo
separate le due semireazioni in modo tale che il flusso compi un
percorso esterno al sistema di reazione, è possibile trasformare
l'energia in lavoro.
Il lavoro svolto dal flusso di elettroni si chiama f.e.m.
( forza elettromotrice ) o potenziale elettrico.
I sistemi che trasformano una redox in un potenziale si dicono
celle elettrochimiche o pile elettrochimiche.
Una pila è formata da due elementi galvanici ( semicelle ) formati ognuno da una lamina metallica immersa in una soluzione salina dello stesso metallo.
I due elementi sono collegati da un ponte salino ( tubo
ad U contenente una soluzione concentrata, ad es., di KNO3 o di NH4Cl, ) che permette la
migrazione degli ioni al fine di mantenere elettricamente neutre
le soluzioni senza il completo mescolamento delle stesse; tale
evenienza farebbe, infatti, sì che gli ioni possano scambiarsi
direttamente per contatto gli elettroni senza generare alcuna
f.e.m.. Il ponte salino può essere sostituito da un setto
poroso con la stessa funzione.
Le due lamine metalliche sono collegate
con fili elettrici ad un circuito esterno comprendente un
utilizzatore, in genere un voltmetro o un multimetro.
Nel circuito passeranno gli elettroni partendo dall'elettrodo che
ne possiede di più, ovvero quello della semicella ove si ha
l'ossidazione ( anodo o polo negativo ), per
giungere all'elettrodo della semicella ove si ha la riduzione ( catodo
o polo positivo ). Attraverso il voltmetro o il multimetro
è possibile misurare la f.e.m. generata.
Quando il sistema raggiunge l'equilibrio, il
processo ha termine.
Potenziale standard ( E0
): si intende il potenziale di una redox che si svolge a 25 °C e
a 1 atm. tra un elettrodo di un qualsiasi metallo in una
soluzione 1 M di un suo sale ed un elettrodo ad idrogeno.
Esecuzione dell'esperienza:
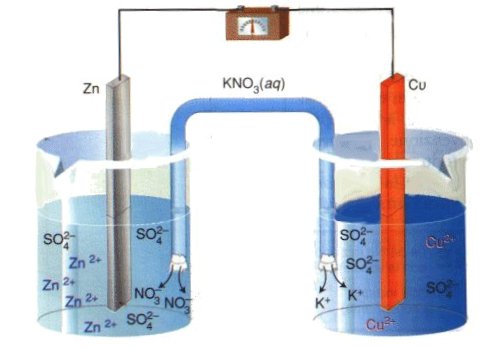
Parte prima: cella Zn // Cu :
Si pongono in un becker ca. 100 mL di soluzione 0.1 M di solfato
di rame immergendo la lamina di rame. In un secondo
becker si pone una identica quantità di solfato di zinco
sol. 0.1 M immergendo la laminetta di zinco. Si collegano
con due fili di diverso colore la lamina di rame all'ingresso
positivo del voltmetro e la lamina di zinco all'ingresso
negativo.
Si riempie completamente il tubo ad U di soluzione concentrata di nitrato di potassio, tappando le due estremità con due batuffoli di cotone; il tubo serve, come detto, da ponte salino.
Si rovescia il ponte salino, controllando che vi sia
continuità e si immergono i tubi nei due beckers. Se tutto è
stato fatto correttamente, sul voltmetro si può osservare una f.e.m.
di 1.1 volts circa.
Detta f.e.m. è data dalla differenza tra i potenziali dei due
elettrodi:
La reazione di ossidoriduzione che si è
verificata è la seguente:
| ossidazione | Zn ----> Zn2+ + 2e |
| riduzione | Cu2+ + 2e ----> Cu |
| --------------------------------- | |
| Zn + Cu2+----> Zn2+ + Cu |
Lo zinco funziona da anodo ( polo
negativo ) e, quindi si ossida consumandosi, mentre il rame
funziona da catodo ( polo positivo ) riducendosi e,
quindi, aumentando di volume.
Se si dispone di un amperometro o di un
multimetro, collegandolo al posto del voltmetro, è possibile
misurare l'intensità della corrente.
Parte seconda: Cella Mg // Cu:
Si opera come nella fase seguente, sostituendo il becker della semipila Zn con un becker contenente 100 mL circa di soluzione 0.1 M di solfato di magnesio ed immergendo una lamina di magnesio.
Si osserverà una f.e.m. di circa 2.71
volts.
Detta f.e.m. è data dalla differenza tra i
potenziali dei due elettrodi:
La reazione di ossidoriduzione che si verifica
è la seguente:
| ossidazione | Mg ----> Mg2+ + 2e |
| riduzione | Cu2+ + 2e ----> Cu |
| --------------------------------- | |
| Mg + Cu2+ ----> Mg2+ + Cu |
Il magnesio funziona da anodo ( polo
negativo ) e, quindi si ossida consumandosi, mentre il rame
funziona da catodo ( polo positivo ) riducendosi e,
quindi, aumentando di volume.
Anche in questo caso è possibile misurare
l'intensità della corrente con l'ausilio di un amperometro.
Sommario
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |