 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Determinazione della curva di
titolazione della reazione NaOH + HCl
Materiali occorrenti:
pHmetro digitale - Buretta da 25 mL - Acido cloridrico sol.0.1 M - Idrossido
di sodio sol. 0.1 M - Vetreria.
Richiami teorici:
L'esperienza riguarda una reazione di neutralizzazione di un acido forte con una base forte ed ha lo scopo di determinare la curva di titolazione, ovvero il grafico che rappresenta la variazione del pH della soluzione acida all'aggiunta di ioni OH-.
Intorno al punto di equivalenza ( p.e. ) si verifica una notevole variazione del pH ( salto di pH ) in quanto, vicino alla neutralità, ove si ha
[OH -] = [H3O+]
= 1 • 10-7 M, anche un piccolo eccesso di base o di
acido provoca notevoli variazioni della concentrazione degli stessi ioni e, di
conseguenza, del pH. L'eccesso di base o di acido ha, ovviamente, effetti tanto
meno evidenti sul pH quanto maggiore è il valore di [OH -] o di [H3O+] che si
trovano in soluzione.
Esecuzione dell'esperienza:
Si predispone il pHmetro, opportunamente tarato con le soluzioni
tampone, con le sonde lavate con acqua distillata. Si prelevano, con pipetta
tarata, 10 mL di acido cloridrico sol. 0.1 M, facendoli sgocciolare accuratamente in un becker da 250 mL; ad essi
si aggiungono 90 mL di acqua distillata. Nei 100 mL di soluzione così
preparata si trovano 0.001 moli di HCl.
Si riempe con cura, fino alla tacca zero, una buretta da 25 mL con la
soluzione di idrossido di sodio 0.1 M e la si pone sul suo sostegno. Si
mette il becker con l'acido sotto la buretta, si immergono le sonde del pHmetro,
si attende un minuto circa al fine di compensare la temperatura e si rileva il
valore del pH. Poichè la soluzione preparata è una soluzione 0.01 M di acido
cloridrico, il valore di pH dovrà essere, nei limiti degli errori sperimentali, = 2 .
Si registra sul foglio di lavoro il valore reale di pH e si procede quindi
allo sgocciolamento della soluzione basica, un mL alla volta, registrando ogni
volta il valore di pH raggiunto. Per una ottimale misurazione, ad ogni
intervallo, si agita per alcuni secondi la soluzione nel becker con un bacchetta
ed attendere almeno 30 secondi per stabilizzare la lettura. Ovviamente le
letture della buretta devono essere molto precise.
Da 9 ad 11 mL di NaOH sgocciolati è consigliabile effettuare letture ogni 0.2
/ 0.3 mL al fine di poter cogliere precisamente il punto di equivalenza ( pH = 7 ). Dopo si continua l'operazione, di mL in mL, fino alla quantità di
20 mL
Se le soluzioni sono a titolo preciso il p.e. si ritrova, ovviamente, molto
vicino al valore di 10 mL
Al termine dell'operazione si risciacquano ed asciugano le sonde del pHmetro
e si ripone l'apparecchio.
Con i dati registrati è possibile ricavare il grafico dell'andamento della
titolazione; in un foglio di carta millimetrata si disegnano i due assi
cartesiani, ponendo nelle ascisse i mL di NaOH sol. 0.1 M sgocciolati e nelle ordinate i valori di pH
rilevati. Si collegano i punti con la miglior retta possibile e, se tutto è
andato correttamente, si può osservare un grafico simile a quello di seguito
rappresentato.
Ovviamente, è possibile elaborare i dati attraverso l'uso di un foglio
elettronico, quale Microsoft Excel.
Nella colonna A si dispongono le quantità di idrossido di
sodio in mL, da 0 a 20, e nella colonna B i corrispondenti valori di pH; si stampa il foglio su carta. Con gli opportuni
comandi si sceglie il grafico di tipo XY e si dichiarano i valori della colonna
A come valori di X e quelli della colonna B come valori di Y; si aggiungono
eventuali legende, si visualizza e si stampa il grafico ottenuto.
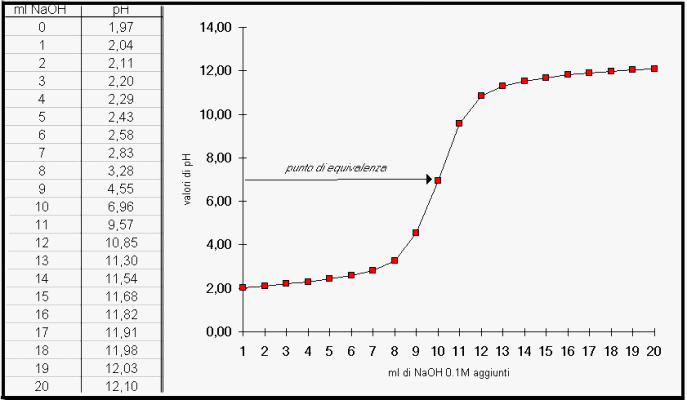
Curva di titolazione
Nota operativa: la titolazione può essere, ovviamente
effettuata, all'inverso, titolando l'idrossido di sodio 0.1 M con l'acido
cloridrico 0.1 M.
Qualora le soluzioni non fossero precise è necessario inserire i relativi
fattori di correzione.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |