Influenza della concentrazione di
alcuni ioni
nella conducibilit� di soluzioni
Materiali occorrenti:
Acido cloridrico sol. 0.1 M - Idrossido di sodio sol. 0.1 M - Acido solforico
sol. 0.05 M - Idrossido di bario sol. 0.1 M - Fenolftaleina sol. 1 % -
Conducimetro - Multimetro - Burette da 25 mL - Vetreria.
Esecuzione dell'esperienza:
Parte prima: reazione di neutralizzazione tra acido
cloridrico ed idrossido di sodio:
In un becker da 250 mL si pongono 10 mL di idrossido di sodio sol. 0.1
M; si aggiungono ca. 100 mL di acqua
distillata e 2 o 3 gocce di fenolftaleina. La soluzione basica risulter�
colorata in viola. Si immerge l'elettrodo del conducimetro e si prende nota del
valore della conducibilit�.
Si inizia a far gocciolare da una buretta la soluzione di acido
cloridrico 0.1 M, agitando nel becker con una bacchetta. La reazione che avviene
� la seguente:
Na+
OH -
+ H+ Cl -��
Na+
Cl -
+ H2O
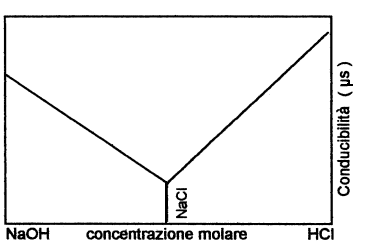
Procedendo, � possibile notare una progressiva
diminuzione della conducibilit� , rilevata dal conducimetro, a causa
della diminuzione della concentrazione degli ioni OH
-, fino al punto di neutralizzazione, evidenziato dalla scomparsa
del colore viola dell'indicatore.
A questo momento la conducibilit� non diviene nulla, in quanto
nella soluzione � presente cloruro di sodio dissociato ( Na+
Cl -
).
Continuando a far gocciolare l'acido cloridrico nel becker, si
verifica un progressivo aumento della conducibilit� per l'aumento della
concentrazione degli ioni H+
nella soluzione .
Parte seconda: reazione di neutralizzazione tra acido
solforico ed idrossido di bario:
In un secondo becker si pongono 10 mL di idrossido di bario
sol. 0.1 M, aggiungendo circa 100 mL di acqua
distillata ed alcune gocce di fenolftaleina. Anche in questo caso la
soluzione risulter� colorata in viola. Analogamente alla prima fase si immerge
l'elettrodo del conducimetro e si rileva il valore.
Si fa gocciolare da una buretta la soluzione di acido
solforico 0.05 M, agitando nel becker con una bacchetta. Anche questa � una
reazione di neutralizzazione:
Ba2+
+ 2OH - + 2H+
+ SO42-
��
BaSO4
�
+2H2O
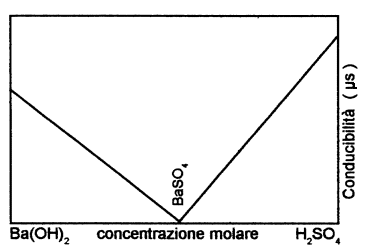
Con il procedere della reazione si nota una diminuzione
della conducibilit�, fino al punto di neutralizzazione ove la conducibilit�
sar� praticamente nulla in quanto saranno disponibili solo pochissimi ioni del
sale e pochissimi dell'acqua.
Aggiungendo altro acido solforico la si verifica un aumento
di conducibilit� per maggior concentrazione degli ioni H+ nella
soluzione .
Dai dati sperimentali, qualora sia stato possibile effettuare
letture precise ed in numero significativo, � possibile osservare che, ad
eguali concentrazioni di ioni OH - e
H +, � la soluzione acida ad avere una conducibilit�
lievemente superiore. Ci� � dovuto alla maggiore "mobilit� " degli ioni H+
rispetto gli OH -.
Non disponendo di un conducimetro � possibile effettuare l'esperimento usando un
multimetro o tester come misuratore della resistivit� che, come � noto, �
l'inverso della conducibilit�.
Sommario
|