 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Le aldeidi e i chetoni
Materiali occorrenti:
Aldeide acetica - Aldeide formica - 1-butanolo - 2-propanolo -
Acetone - Bicromato di potassio cristallino - Acido solforico sol. 95 % -
Nitrato di argento sol. 0.1 M - Idrossido di ammonio sol. 2 % - Idrossido di
sodio sol. 1 M - Reattivi di Fehling - Piridina - Vetreria.
Richiami teorici:
Le aldeidi ed i chetoni sono caratterizzati dal gruppo funzionale carbonile C=O . Il legame C=O è composto da un legame di tipo σ e da uno di tipo π ; il carbonio è ibridato sp2 e la molecola è planare. Nelle aldeidi un gruppo carbonilico è legato a uno o a due atomi di idrogeno e a non più di un radicale alchilico, secondo la formula generale :
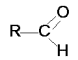
Nei chetoni il gruppo carbonile è legato direttamente a due radicali alchilici , secondo la formula:
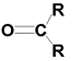
In laboratorio è possibile preparare aldeidi per ossidazione
di alcooli primari e chetoni per ossidazione di alcooli secondari.
Esecuzione dell'esperienza:
Parte prima: preparazione dell'aldeide n-butirrica per ossidazione dell' 1-butanolo con bicromato di potassio:
In una provetta si introducono 3 mL di 1-butanolo e 1 mL circa di acqua distillata; a questa soluzione si aggiungono una punta di spatola di bicromato di potassio agitando fino a completa solubilizzazione del sale. La soluzione appare di colore arancio intenso. Si aggiungono, con cautela, 1 mL di piridina, al fine di evitare l'ulteriore ossidazione ad acido carbossilico e 2 o 3 gocce di acido solforico sol. 95 %. Si porta la provetta sul bunsen e si scalda lentamente; subito si nota il viraggio del colore arancio ( colore del Cr6+ ) ad un colore verde tenue ( colore del Cr3+ ) ad indicare la riduzione del cromo con contemporanea ossidazione dell' alcool n-butilico ad aldeide butirrica ( butanale ), secondo la reazione:
3CH3 - CH2 - CH2 - CH2 - OH + Cr2O72-+
8H+ ---> 3CH3 - CH2 - CH2 - CHO + 2Cr3+ + 7H2O .
L'aldeide n-butirrica è riconoscibile dal
caratteristico odore.
Parte seconda: preparazione dell'acetone per ossidazione del 2-propanolo con bicromato di potassio:
In una provetta si introducono 3 mL di 2-propanolo e 1 mL circa di acqua distillata; a questa soluzione si aggiungono una punta di spatola di bicromato di potassio agitando fino a completa solubilizzazione del sale. La soluzione appare di colore arancio intenso. Si aggiungono, con cautela, 2 o 3 gocce di acido solforico sol. 95 %. Si porta la provetta sul bunsen e si scalda lentamente; subito si nota il viraggio del colore arancio ( colore del Cr 6+ ) ad un colore verde tenue ( colore del Cr 3+ ) ad indicare la riduzione del cromo con contemporanea ossidazione del 2-propanolo ad acetone ( propanone ), secondo la reazione:
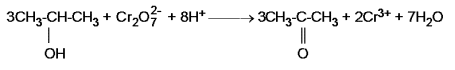
Il chetone è molto più stabile dell'aldeide, per cui non può aver luogo una ulteriore ossidazione ad acido carbossilico. L'acetone è riconoscibile dal caratteristico odore.
Parte terza: reazione di Tollens e formazione dello specchio d'argento:
Con questa reazione è possibile verificare il potere riducente delle aldeidi.
Il reattivo di Tollens è deperibile e si prepara al
momento versando in una provetta 2 mL di nitrato di argento sol. 0.1 M,
1-2 gocce di idrossido di sodio
sol. 1 M ed alcune gocce di idrossido di ammonio sol. 2 % , fino a
completa soluzione.
In una seconda provetta si versano 1-2 mL di aldeide ( formica o acetica ), si aggiungono 5 o 6 gocce del reattivo di Tollens e si porta al bunsen per un cauto riscaldamento. Dopo pochi secondi si nota sul fondo della provetta la comparsa dello specchio d'argento dovuto alla riduzione di Ag+ a argento elementare. La reazione generica che avviene è:
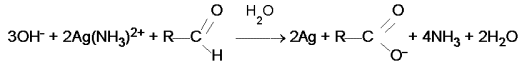
Come si vede, l'aldeide si ossida al corrispondente acido carbossilico.
Nota operativa: operare con guanti in gomma monouso al
fine di evitare macchie di argento metallico sulle mani.
Parte quarta: esame del differente potere riducente di aldeidi e chetoni con reattivo di Fehling:
Questa esercitazione evidenzia il differente potere riducente di aldeidi e chetoni.
Il reattivo di Fehling è costituito da due soluzioni, la soluzione A di solfato di rame II e la soluzione B alcalina di tartrato di sodio e potassio .
Al momento dell'analisi si mescolano in una provetta 5 mL per
ciascuna delle due soluzioni.
In una provetta si versano 2 mL di aldeide ( formica o acetica ) e in una seconda provetta 2 mL di acetone. Si pongono le provette in un bagnomaria caldo ( o in un becker con acqua calda ) e si versano, in ciascuna, 3 o 4 mL di reattivo di Fehling completo. Nella provetta contenente l'aldeide si osserva il formarsi di un precipitato bruno di ossido di rame I ( riduzione del Cu 2+ del solfato a Cu+ nell'ossido ) e contemporanea ossidazione dell'aldeide ad acido carbossilico, con la reazione:

Nella provetta contenente il chetone non si ha alcuna
reazione redox: questi composti carbonilici, infatti, reagiscono solo con
energici ossidanti ( es. permanganato di potassio a caldo ).
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |