 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Gli alcheni
Materiali occorrenti:
1-ottene - Esano - Tetracloruro di carbonio - Permanganato di
potassio sol. 0.001 M - Idrossido di sodio sol. 1 M - Acqua di bromo satura -
Paraffina - Cloruro di sodio - Etanolo - Iodio bisublimato - Vetreria.
Richiami teorici:
Gli alcheni ( oleofine ) sono composti nei quali il carbonio è ibridato sp2.
Ogni orbitale forma con quelli vicini angoli di 120°. Tra due atomi di carbonio
è presente un doppio legame formato da un legame di tipo s e da una nube elettronica ad esso perpendicolare che corrisponde
al legame p; questo è, perciò, formato
dall'orbitale p non ibridato che si sovrappone ad un altro orbitale p non
ibridato dell'atomo di carbonio vicino. La formula generale è CnH2n .Hanno comportamento apolare. Gli alcheni da C2 a C4 sono gassosi; liquidi da C5 a C16 e solidi quelli da C17 in poi.
Le reazioni degli alcheni comportano, in genere, la rottura del legame, addizionando ioni o radicali. Sono possibili reazioni di ossidazione con ossidanti forti.
In queste note sono trattate, in generale, le reazioni
facilmente eseguibili in laboratorio, ovvero le reazioni di ossidazione a
glicoli e di addizione di alogeni.
Ossidazione a glicoli:
alcuni ossidanti energici, ad es. permanganato di potassio, in ambiente alcalino e a freddo, trasformano gli alcheni in glicoli ( o dioli), alcooli con due gruppi -OH. La reazione, riferita all'etilene è la seguente:
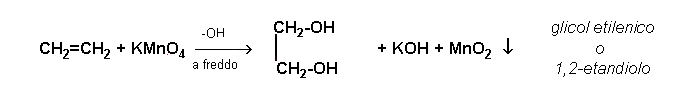
Addizione di alogeni:
gli alcheni reagiscono con facilità con bromo e cloro venendo trasformati in composti saturi contenenti 2 atomi di alogeno legati ad atomi adiacenti di carbonio. Questi composti sono detti alogenuri alchilici. La reazione avviene miscelando alchene e alogeno in soluzione di tetracloruro di carbonio. La reazione, riferita all'etilene è la seguente:
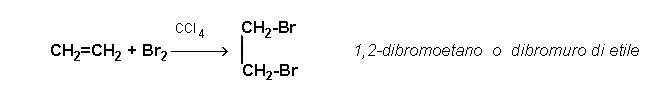
Esecuzione dell'esperienza:
Parte prima: ossidazione a glicol dell' 1-ottene:
In una provetta porre 3 o 4 mL di permanganato di potassio sol. 0.001 M ed alcalinizzare con 2 o 3 gocce di idrossido di sodio sol,
1 M;
si aggiunge, infine, 1 mL di 1-ottene ed agitare.
In breve si osserva la scomparsa della colorazione viola, con comparsa di un colore bruno tenue; ciò indica l'avvenuta riduzione del Mn7+ a Mn4+ con contemporanea ossidazione dell'1-ottene a glicol ottilenico ( 1,2-ottandiolo ) con la reazione:
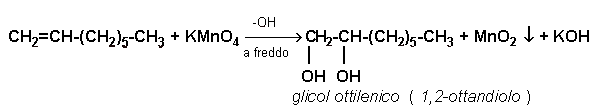
Nota: la comparsa di una colorazione verdastra indica che non è avvenuta una completa riduzione del Mn7+ a Mn4+ ma, bensì, una parziale riduzione a Mn6+. Questo può essere dovuto o ad una concentrazione molare di KMnO4 troppo elevata o ad una basicità troppo accentuata. Quest'ultima situazione provoca, infatti, uno stabilizzarsi del Mn6+.
Per ovviare a quanto sopra conviene ripetere l'esperienza con
soluzione di permanganato più diluita ed alcalinizzando meno. Al limite, può
favorire la reazione un blando riscaldamento al bunsen.
Parte seconda: addizione di bromo all'1-ottene:
Si pongono in una provetta 4 o 5 mL di acqua di bromo satura e si aggiunge 1 mL circa di 1-ottene, agitando la miscela. In
breve si osserva lo scolorimento dell'acqua di bromo ad indicare che il bromo
stesso si è legato all'alchene, rompendo il doppio legame e formando un alogenuro alchilico:
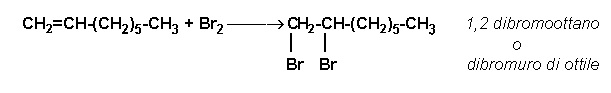
Parte terza: prove comparative di miscibilità e solubilità:
Gli alcheni hanno comportamento apolare. E' possibile
verificare tale comportamento con prove di miscibilità da effettuarsi con altri
idrocarburi o
derivati ( es. esano, benzene, tetracloruro di carbonio, cloroformio ) e con solventi polari (es. acqua o etanolo ).
Prove di solubilità nell'alchene possono essere effettuate, ad
esempio, con un alcano solido ( paraffina ) e con sostanze di tipo
molecolare ( es. iodio, saccarosio ) o ionico ( es. cloruro di sodio ).
I risultati delle prove di cui sopra possono
essere raccolti in una tavola sinottica appositamente preparata.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |