 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Gli acidi carbossilici
Materiali occorrenti:
Acido acetico glaciale. - Acido ossalico - Acido oleico -
Etanolo - Acido solforico sol. 95% - Bicromato di potassio cristallino -
Idrossido di sodio sol. 0.1 M - Magnesio - Idrossido di bario sol. 1 % -
Fenolftaleina sol. 1 % Cartine indicatrici - Vetreria .
Richiami teorici:
Gli acidi carbossilici sono composti organici caratterizzati dal gruppo carbossile
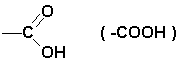
Il carbossile può essere legato ad un radicale alifatico -R ( acidi carbossilici alifatici ) o ad un anello benzenico ( acidi carbossilici aromatici ).
Nel caso che la molecola presenti due gruppi -COOH l'acido è genericamente detto dicarbossilico o alcandioico. Es.

Gli a.c. hanno carattere polare, formano legami ad idrogeno
tra le loro molecole e con molecole di H2O. Aumentando di dimensione
la catena alifatica diminuisce la funzione carbossilica e con essa la solubilità
in acqua.
Gli a.c. a catena semplice sono liquidi, quelli ad
elevato P.M. sono solidi.
Esecuzione dell'esperienza:
Parte prima: esame delle caratteristiche fisiche di alcuni acidi carbossilici:
Disponendo di più a.c. è possibile effettuare un esame delle
caratteristiche, quali lo stato fisico (liquido o solido), la densità, l'odore,
la miscibilità con acqua o con eventuali solventi apolari, il pH, la
conducibilità elettrica di soluzioni a diverse concentrazioni.
I dati raccolti sperimentalmente possono essere riportati in
una tabella appositamente preparata.
Parte seconda: preparazione di acido acetico per ossidazione di etanolo con bicromato di potassio:
Si basa sulla reazione generica:
ossidazione --->
R - OH ---> R - CHO ---> R - COOH
In un pallone codato da 100 mL si pongono 20 mL di alcool
etilico 95° e 20 mL di acqua distillata. Si agita per mescolare perfettamente e
si aggiunge una punta di spatola di bicromato potassico; la soluzione
assume il colore caratteristico arancio del Cr6+. Goccia a goccia, si versano 2
mL ca. di acido solforico sol. 95 % , si tappa e si porta sul bunsen con
reticella amiantata per un cauto riscaldamento. In poco tempo si osserva il
cambiamento del colore al verde ad indicare la riduzione del Cr6+ a Cr3+;
contemporaneamente si ha l'ossidazione dell'alcool etilico ad acido acetico,
che distilla dalla tubolatura del palloncino e che è riconoscibile per il
caratteristico odore, ben diverso da quello dell'alcool e per il pH acido,
verificabile con una cartina all'indicatore universale.
La reazione è:
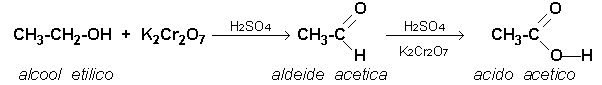
Parte terza: reazioni di salificazione:
Gli a.c. possono dare reazioni di salificazione sia con idrossidi sia con metalli.
Ad esempio una reazione di salificazione acido-base è quella
tra l'acido acetico dell'aceto di vino e una soluzione di idrossido di
sodio, già vista nella relativa esercitazione, alla quale si rimanda per le
modalità di esecuzione.
Una semplice reazione acido-metallo può essere quella tra il magnesio e l'acido acetico.
In una provetta si versano 5 mL di acido acetico glaciale e 5 mL di acqua distillata e si immerge una lastrina di magnesio. Si nota lo sviluppo di gas idrogeno ed il formarsi, in
soluzione, di acetato di magnesio, con la reazione:
2CH3-COOH
+ Mg ---> (CH3 - COO)2Mg + H2 ↑
La descritta reazione può essere effettuata anche con altri
metalli reattivi, quali il sodio o il calcio.
Parte quarta: reazione di decarbossilazione dell'acido ossalico:
In una provetta si versa una spatolata di acido ossalico cristallino; si chiude la provetta con un tappo con tubo di sviluppo che sarà immerso in una soluzione di idrossido di bario contenuta in una seconda provetta. Si porta la provetta con l'acido ossalico al bunsen e si riscalda fino a 160-180°C e si nota lo sviluppo di gas, anidride carbonica, che intorbidirà, come noto, l'idrossido di bario. La reazione è:
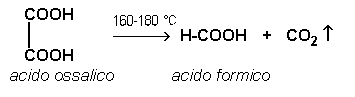
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |