 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
L'accumulatore al piombo
Materiali occorrenti:
Cella elettrolitica - Lamine di piombo - Acido solforico sol.
10 % ca. - Alimentatore in c.c. da 6/12 volts - Voltmetro - Amperometro -
Lampadina 1.5 V, 0.5 A - Cavi.
Richiami teorici:
Gli accumulatori al piombo sono delle pile reversibili;
possono, infatti, accumulare corrente ( processo di carica ) oppure
generare corrente ( processo di scarica ),in quanto la reazione di
ossidoriduzione che avviene può procedere nei due sensi.
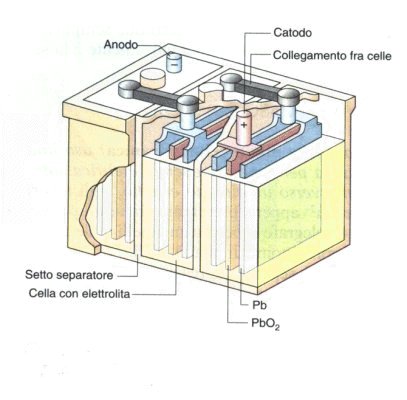
Gli accumulatori sono costituiti da un anodo (-)
costituito da piastre in piombo e da un catodo (+) costituito da
piastre in piombo rivestite da biossido di piombo
( PbO2 ); gli
elettrodi sono immersi in un elettrolita, costituito da una soluzione circa al
20 - 30 % di acido solforico.
L'accumulatore può essere così schematizzato:
( - ) Pb / H2SO4 / PbO2 ( + )
Nel processo di scarica l'accumulatore funziona da cella
galvanica e fornisce energia elettrica trasformando l'energia chimica: all' anodo ( - ) avviene una reazione reversibile di ossidazione ,
mentre al catodo ( + ) si ha una reazione reversibile di riduzione.
| ossidazione | Pb(s) + SO42-(aq) ---> PbSO4 (s) + 2e |
| riduzione | PbO2 (s) + 4H+ + SO42-(aq) + 2e ---> PbSO4 (s) + 2H2O |
| ------------------------------------------------------- | |
| Pb(s) + PbO2 (s) + 4H+ + 2SO42-(aq) ---> 2PbSO4 (s) + 2H2O |
La f.e.m. teorica di un elemento di accumulatore al
piombo può essere facilmente calcolata osservando i potenziali standard di
riduzione delle due semireazioni:
| Pb(s) + SO42-(aq) ---> PbSO4 (s) + 2e | E0 = -0.36 V |
| PbO2 (s) + 4H+ + SO42-(aq) + 2 --->PbSO4 (s) + 2H2O | E0 = +1.69 V |
| ------------------------------------------------------- | ------------ |
| Pb(s) + PbO2 (s) + 4H+ + 2SO42-(aq) ---> 2PbSO4 (s) + 2H2O | E0 = +2.04 V |
Questo valore è riferito ad una situazione standard ( 25°C e
concentrazione 1 M ); in pratica, un elemento al piombo in cui la concentrazione
di H2SO4 sia 4 / 5M ( 20 / 30 % ) , la f.e.m. è di circa 2.2 v e tende a scendere, durante l'utilizzo, a circa 2 v.
Nel processo di carica le reazioni che si verificano ai
due poli sono uguali ma opposte a quelle descritte, in quanto sono provocate
dall'energia elettrica fornita da un generatore; con essa si trasforma PbSO4 in Pb e PbO2.
La tensione da fornire deve essere di circa 2.2 v, e non deve essere
superata; infatti quando la tensione applicata raggiunge i 2.4 v si ha
elettrolisi dell'acqua con sviluppo di H2 ed O2 Ciò porta
ad un inutile consumo di energia elettrica e a deterioramento delle placche
dell'accumulatore, per azione dei gas.
Nel processo di scarica è opportuno non far diminuire mai la f.e.m. sotto 1.8 v per elemento. Questa evenienza porterebbe al processo di solfatazione dell'elemento. Il PbSO4 che si forma normalmente è un sale poco solubile ed aderisce alle piastre sotto forma di granuli molto piccoli.
Se la f.e.m. scende sotto 1.8 v si formano dei granuli
molto grossi che non riescono più a ritrasformarsi nel processo di carica.
In pratica la fine della vita di una batteria di accumulatori al piombo è dovuta al processo di solfatazione.
La reazione complessiva dell'accumulatore al piombo è,
in definitiva, la seguente:
| scarica ---> | Pb(s) + PbO2 (s) + 2H2SO4 (sol) <---> 2PbSO4 (s) + 2H2O | <--- carica |
Esecuzione dell'esperienza:
Il modello didattico di accumulatore al piombo è formato da una cella elettrolitica in vetro, da due lamine in piombo e da un sostegno isolato per dette.
Nella cella si pone la soluzione di acido solforico ,
fino a ca. 4 cm. dal bordo.
Si immergono le lamine di piombo, montate sul supporto
isolato, e, tramite due cavi, le si collegano ad un generatore di corrente
continua da 6 v. . In breve
sull' anodo si nota un annerimento per formazione di PbO2 dovuto all'elettrolisi.
Trascorsi alcuni minuti per la carica, si disconnettono i cavi
e si misura la f.e.m. espressa dall'accumulatore collegando il voltmetro alle
lamine, nel rispetto della polarità.
Tale f.e.m. espressa è di circa 2 v.. Il tipo di
corrente è, ovviamente, continua.
Dopo questa fase si collega l'accumulatore all'amperometro e
ad un utilizzatore, quale, ad esempio, una lampadina da 1.5 V, 0.3 A,
costituendo un idoneo circuito. Si determina l'intensità della corrente
restituita. Nel caso dell'accumulatore didattico descritto essa è pari a circa
0.5 A.
Se si lascia attivo il sistema, si nota che l'intensità e,
quindi, la luce emessa dalla lampadina tendono rapidamente a decrescere,
ovviamente in proporzione al tempo di carica.
In base alle risultanze dell'esperienza è facile comprendere
perché gli accumulatori per veicoli hanno tensioni multiple della f.e.m.
espressa da una singola cella, ad esempio, 6 o 12 volts: sono costituiti,
infatti, da 3 o 6 celle elementari collegate in serie.
Disponendo di almeno due celle elettrolitiche didattiche è
possibile verificare quanto sopra; inoltre è possibile verificare che il
collegamento in parallelo di due o più celle elementari non porta ad aumento
della tensione ma, bensì, a quello dell'intensità.
Al termine dell'esperienza si svuota la cella elettrolitica,
si lava il tutto con acqua corrente, lasciando asciugare all'aria.
L'accumulatore al piombo
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |