Storia degli elementi chimici
Il prof. Gian Giacomo Guilizzoni mi ha fatto pervenire una interessantissima tabella con le date di scoperta, lo scopritore e l’etimo degli elementi della tavola periodica. Leggi tutto… “Storia degli elementi chimici”
35 anni di Laboratorio di Chimica non si dimenticano facilmente…
Il prof. Gian Giacomo Guilizzoni mi ha fatto pervenire una interessantissima tabella con le date di scoperta, lo scopritore e l’etimo degli elementi della tavola periodica. Leggi tutto… “Storia degli elementi chimici”
Il Premio Nobel per la Chimica è stato assegnato, come accade da ormai diversi anni, a tre studiosi. Si tratta di Jacques Dubochet (Svizzera, 1942), Joachim Frank (Germania, 1940) e Richard Henderson (Gran Bretagna, 1945). La motivazione scelta dal Comitato del Premio è “Per aver sviluppato la microscopia crioelettronica per determinare in alta definizione le strutture delle biomolecole”.
E con questo sono 54 anni che un ricercatore italiano non riceve il Nobel per la Chimica: l’ultimo fu nel 1963 Giulio Natta. D’altra parte non ci si potrebbe aspettare di meglio visto il livello della ricerca italiana nel settore e dei finanziamenti che Stato ed industria assegnano.
Il prof. Gian Giacomo Guilizzoni mi ha fatto pervenire un eccezionale contributo: una raccolta molto estesa di esercizi svolti di Chimica che spaziano tra i vari ambiti, dalla chimica-fisica, all’equilibrio chimico, allo stato gassoso, alle redox e tanto altro.
Un lavoro straordinario, come sempre è stata la produzione scientifica del prof. Guilizzoni che è di rifermento per la didattica della Chimica.
Nel sito del prof. Guilizzoni, http://www.apertisverbis.it, e nella sezione di didattica della Chimica di questo sito, sono presenti diversi articoli dell’Autore.
Esercizi di chimica risoltiPubblico volentieri un contributo del prof. Gian Giacomo Guilizzoni sulle concentrazioni delle soluzioni.
prof. Gian Giacomo Guilizzoni
La concentrazione di una miscela è il rapporto esistente tra le parti (in massa o in volume) di un componente e le parti (in massa o in volume) di miscela. Per le soluzioni, è il rapporto esistente tra le parti (in massa o in volume) di soluto e le parti (in massa o in volume) di soluzione, o di solvente.
Definizioni(*)
| soluto | solvente | soluzione | ||
| percento in massa | % m/m | g | 100 g | |
| percento di solvente | % s | g | 100 g | |
| percento in volume m/V | % m/V | g | 100 ml | |
| percento in volume V/V | % V/V | ml | 100 ml | |
| grammi al litro | g/l | g | 1000 ml | |
| parti per milione | ppm | mg | 1000 ml | |
| parti per billion | ppb | mg | 1000 ml | |
| parti per trillion | ppt | ng | 1000 ml | |
| molarità | mol/l | mol | 1000 ml | |
| osmolarità | osm/l | osm | 1000 ml | |
| molalità | mol/kg solv. | mol | 1 kg | |
| normalità | eq/l | eq | 1000 ml | |
| concentrazione catalitica | kat/l | kat | 1000 ml | |
| frazione molare | x | mol | moli totali | |
| libbra al gallone | lb/gal | lb | 1 gal | |
| libbra al pollice cubo | lb/in3 | lb | 1 in3 | |
| libbra al piede cubo | lb/ft3 | lb | 1 ft3 | |
| oncia al gallone | oz/galUSA | oz | 1 galUSA |
(*) Soltanto le concentrazioni espresse in massa (% m/m, frazione molare, % s, molalità) non dipendono dalla
temperatura.
Fattori di conversione (1).
| % m/m | % m/V | g/l | ppm | mol/l | |
| % m/m | 1 | d | 10 d | 104 d | 10 d / M |
| % m/V | 1 / d | 1 | 10 | 104 | 10 / M |
| g/l | 10-1 / d | 10-1 | 1 | 103 | 1 / M |
| ppm | 10-4 / d | 10-4 | 10-3 | 1 | 10-3 / M |
| mol/l | 10-1 M / d | 10-1 M | M | 103 M | 1 |
% m/m, percento in massa; % m/V, percento in volume m/V; g/l, grammi al litro; ppm, parti per milione;
mol/l, molarità; d, massa volumica della soluzione in g/cm3; M, massa formale del soluto.
Fattori di conversione (2).
| mol/kg | % s | |
| mol/kg | 1 | M / 10 |
| % s | 10 / M | 1 |
mol/kg, molalità; % s, percento di solvente;
M, massa formale del soluto.
Fattori di conversione (3).
| % m/V | % V/V | |
| % m/V | 1 | 1/D |
| % V/V | D | 1 |
% m/V, percento in volume m/V; % V/V, percento in
volume V/V; D, massa volumica del soluto in g/cm3.
(*) I calcoli precedenti sono approssimativi perchè i volumi dei liquidi mescolati spesso non sono additivi: durante la miscelazione può verificarsi una contrazione di volume, che dipende dalla natura dei liquidi e dalla temperatura. Così ad esempio, per la coppia etanolo-acqua, a 20 ºC, mescolando 48 volumi di acqua con 52 volumi di etanolo non si ottengono 100 volumi di soluzione ma soltanto 96,3 volumi, con una contrazione di volume del 3,7 %. I Manuali riportano dettagliate tabelle di conversione.
La versione in PDF del contributo è disponibile qui.
La Royal Swedish Academy of Sciences ha oggi assegnato il Premio Nobel per la Chimica. Come accade da moltissimi anni il premio è stato assegnato a più scienziati: Jean-Pierre Sauvage della University of Strasbourg, France, J. Fraser Stoddart della Northwestern University, Evanston, IL, USA e Bernard L. Feringa della University of Groningen, the Netherlands.
La motivazione è di aver progettato e sintetizzato delle macchine molecolari.
Gli insigniti, con una ricerca iniziata del 1983, hanno sviluppato molecole con movimenti controllabili, in grado di effettuare delle semplici attività quando ad esse sia fornita dell’energia.
Utilizzando più sofisticati computer si è dimostrato che la miniaturizzazione della tecnologia può essere rivoluzionaria e questa ricerca sulle macchine molecolari miniaturizzate proietta la chimica verso una nuova dimensione.
Il primo passo verso le macchine molecolari è stato fatto da Jean-Pierre Sauvage nel 1983, quando riusci a legare due molecole ad anello in una forma a catena (catenane). Come è noto di solito le molecole sono legate da forti legami covalenti, nei quali uno o più elettroni è condiviso tra gli atomi; nelle catenane i legami sono di tipo meccanico e meno forti.
In una macchina molecolare per poter esserci una attività, è necessario che una parte possa muoversi rispetto un’altra e nella ricerca si è visto che due anelli concatenati soddisfano questa necessità.
Nel 1991 Fraser Stoddart sviluppò un composto, il rotaxane, riuscendo ad avvolgere una molecola ad anello lungo una sottile molecola assiale, dimostrando che l’anello era in grado di muoversi intorno all’asse.
Lo sviluppo del rotaxane ha portato alla costruzione di leve molecolari, “muscoli” molecolari ed anche chip molecolari.
Bernard Feringa nel 1999 riuscì a costruire un rotore molecolare in grado di girare continuamente sul proprio asse. Usando un motore molecolare fu in grado di far ruotare un cilindro di vetro la cui massa era 10000 volte quella del motore stesso.
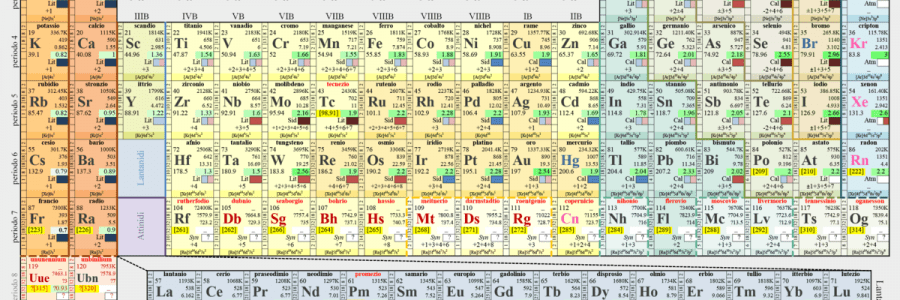
Dopo oltre 10 anni di verifiche la IUPAC, con un comunicato del 30 dicembre 2015, ha finalmente decretato l’esistenza di quattro elementi sintetici del 7° periodo della tavola periodica.
Si tratta dell’elemento Z=113, con simbolo Uut e nome provvisorio Ununtrium (in italiano: Ununtrio), sintetizzato dal laboratorio giapponese RIKEN, dell’elemento Z=115, con simbolo Uup, a nome Ununpentium/Ununpentio, dell’elemento Z=117, con simbolo Uus e nome Ununseptium/Ununseptio, e dell’elemento con Z=118, simbolo Uuo e nome Ununoctium/Ununoctio tutti sintetizzati da una ricerca comune del Joint Institute for Nuclear Research di Dubna, Russia, del Lawrence Livermore National Laboratory, California, USA e del Oak Ridge National Laboratory, Oak Ridge,Tennessee, USA.
I laboratori sono stati invitati dalla IUPAC a formulare il nome permanente degli elementi suddetti.
Il presidente del JWP (Join Working Party tra IUPAC e IUPAP) Mark C. Cesa ha così ricordato le difficoltà del riconoscimento:
“A particular difficulty in establishing these new elements is that they decay into hitherto unknown isotopes of slightly lighter elements that also need to be unequivocally identified”
Gli elementi di cui sopra sono inseriti nella Tavola periodica disponibile in questo sito.
Il Premio Nobel per la Chimica 2015 è stato assegnato, in parti uguali, a Tomas Lindahl, Paul Modrich e Aziz Sancar per gli studi sui meccanismi di riparazione del DNA.
Tomas Lindahl è nato a Stoccolma (Svezia) nel 1938 ed attualmente lavora al Francis Crick Institute, Hertfordshire, UK, e al Clare Hall Laboratory, Hertfordshire, UK.
Paul Modrich è nato nel 1946 a Raton negli USA e lavora al Howard Hughes Medical Institute, Durham, NC, USA, ed insegna alla Duke University School of Medicine, Durham, NC, USA.
Aziz Sancar è nato a Savur, Turchia, nel 1946 e lavora alla University of North Carolina, Chapel Hill, NC, USA.