 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Introduzione alla
chimica
del prof. Augusto Biasotti
1. La chimica: definizioni
La chimica è la disciplina che studia la composizione, la struttura e le trasformazioni della materia.
Il suo metodo di indagine è quello sperimentale o induttivo. tale metodo può essere suddiviso nelle seguenti fasi:
- Osservazione del fenomeno.
- Raccolta di dati sperimentali.
- Formulazione di ipotesi.
- Elaborazione critica dei dati sperimentali.
- Formulazione della legge.
- Applicazione della legge e verifica sperimentale della sua validità.
2 . Definizione di modello in campo scientifico
Per modello si intende la visualizzazione di una realtà invisibile, quindi sconosciuta, mediante una o più immagini concrete tratte dall'esperienza quotidiana.
Il modello formulato non deve essere considerato una riproduzione in miniatura di una realtà macroscopica ( es. un modellino di nave ), bensì uno strumento concettuale di cui ci si serve per interpretare il comportamento delle cose.
2.1 - Modello di gas:
Un gas può essere concepito secondo il seguente modello:
- Formato da piccolissimi corpuscoli o particelle, distaccate tra loro e disperse nello spazio.
- Le particelle sono dotate di movimento senza alcun rapporto di reciproca dipendenza; frequentemente collidono tra loro e con le pareti del contenitore.
- Le forze tra le particelle sono molto modeste.
- Il volume effettivo delle particelle è trascurabile rispetto a quello del contenitore che racchiude il gas.
2.2 - Modello di liquidi:
I liquidi, intermedi tra gas e solidi, possono essere rappresentati secondo questo modello:
- Costituiti da corpuscoli piccolissimi o particelle molto vicine tra loro ma che non occupano posizioni fisse; tra una particella ed un’altra esistono piccoli vuoti.
- Tra le particelle esistono forze attrattive di media intensità che, pur costringendole a rimanere in contatto, permettono loro movimenti di scorrimento le une sulle altre.
2.3 - Modello di solido:
Un solido può essere rappresentato dal seguente modello:
- Formato da piccolissimi corpuscoli o particelle che sono vicinissime tra loro.
- Tra le particelle vi sono forze attrattive molto intense che, oltre a mantenerle in stretto contatto tra loro, ne impediscono ogni apprezzabile movimento; si ammette però che esse possano vibrare intorno alle loro posizioni di equilibrio pur occupando una posizione quasi fissa.
- Le particelle possono risultare distribuite nello spazio con regolarità ( solidi ordinati o cristallini ) oppure senza alcuna regola ( solidi disordinati o amorfi ).
2.2 - Teoria cinetica e corpuscolare della materia:
Secondo tale teoria tutta la materia è formata da particelle ( atomi, molecole o ioni ); esse sono in movimento costante e tutte le collisioni sono perfettamente elastiche ( urto elastico: non si verifica cambiamento dell' energia cinetica totale ).
3. La materia
3.1 - Definizioni:
La materia è tutto ciò che si trova nell'universo ed è dotato di massa propria. Una porzione limitata di materia è detta corpo.
3.2 - I fenomeni:
E' detto fenomeno qualsiasi evento o trasformazione che interessa un corpo. I fenomeni possono essere suddivisi in:
- Fenomeni fisici: quelli che interessano le proprietà fisiche del corpo quali la massa, il volume, il colore, lo stato di aggregazione, il punto di fusione, la conducibilità elettrica.
- Fenomeni chimici: quelli che portano ad un cambiamento della composizione chimica di un corpo (reazioni chimiche).
3.2 - Le sostanze semplici:
Le sostanze semplici, dette comunemente elementi, sono specie chimiche non più scomponibili in sostanze ancora più semplici. Sono costituite da atomi dello stesso tipo.
3.3 - I composti:
Sono specie chimiche costituite da più elementi e, quindi, da atomi di diverso tipo.
3.4 - Le fasi:
Un corpo o un insieme limitato di corpi oggetto di indagini chimico-fisiche è detto sistema. Una porzione di un sistema limitata da superfici fisicamente definite e con una serie di proprietà fisiche costanti in ogni suo punto è detta fase. Un sistema è definito fisicamente omogeneo quando è costituito da una sola fase ( es. l'aria, il vino, le soluzioni ). Un sistema è detto fisicamente eterogeneo quando è costituito da più fasi separate tra di loro da superfici ben definite, osservabili ad occhio nudo o al microscopio. Un miscuglio eterogeneo tra un solido ed un liquido è detto sospensione ( es. miscuglio acqua - sabbia ). Un miscuglio eterogeneo tra due liquidi non miscibili è detto emulsione ( es. latte, miscuglio acqua - olio ).
4. Le grandezze
I fisici definiscono grandezza ogni ente, introdotto per descrivere un fenomeno fisico, che sia, in qualche modo, misurabile. Le grandezze si descrivono con un numero seguito dalla loro unità di misura.
Le grandezze possono essere classificate in:
- Grandezze fondamentali: quelle le cui unità di misura sono definite e fissate, per convenzione, dal Sistema Internazionale ( SI ) sono sette ( vedere sezione "Tabelle" ) .
- Grandezze derivate: derivano dalle precedenti e sono ottenute da queste tramite combinazioni algebriche, prodotti o divisioni. Le più importanti, di interesse dei chimici e dei fisici, sono riportate nella sezione "Tabelle"
Le unità di misura SI molto spesso sono o troppo grandi o troppo piccole, per cui è necessario utilizzare dei loro sottomultipli o dei loro multipli, definiti da prefissi moltiplicatori. In alcuni casi si utilizzano anche unità di misura al di fuori del SI, spesso diverse da paese a paese.
Le grandezze fisiche, fondamentali e derivate, definiscono quindi le proprietà fisiche della materia.
5. Proprietà della materia
5.1 - Generalità:
Le proprietà della materia e, quindi delle sostanze, sono classificabili in:
Proprietà fisiche: sono le grandezze fisiche già viste e dipendono dalla sostanza stessa. Possono essere distinte in:
- Proprietà estensive: dipendono dall'estensione del campione, ovvero dalla quantità di materia dello stesso ( es. volume, massa, lunghezza ).
- Proprietà intensive: non dipendono dalla quantità, bensì dal tipo di materia ( es. punto di fusione, densità ).
- Proprietà chimiche: dipendono in prevalenza dall'influenza di altre sostanze sulla sostanza in esame (es. reattività con l'ossigeno, reattività con l'acqua, reattività con gli acidi).
- Proprietà organolettiche: possono essere percepite e valutate dagli organi di senso (es. sapore, odore, colore).
5.2 - Lunghezza:
Grandezza fondamentale corrispondente alla dimensione orizzontale più estesa. Unità di misura del SI è il metro ( m ).
5.3 - Volume:
E' la porzione di spazio che un corpo occupa; varia in funzione della temperatura e della pressione. Tale variazione non è significativa nei solidi e nei liquidi in quanto, anche se possono subire modeste dilatazioni, sono da considerarsi incomprimibili. Nei gas, invece, è determinante in quanto essi possono subire notevoli dilatazioni o compressioni per effetto, appunto, di pressione e temperatura.
Il volume è una grandezza derivata dalla lunghezza e l'unità di misura, nel SI, è il metro cubo ( m3 ). Detta unità è, però, troppo grande per il chimico che comunemente usa i suoi sottomultipli. Tra questi il più utilizzato è il decimetro cubo ( dm3 ) che corrisponde al volume occupato da un kg di H2O distillata alla temperatura di 4 °C.
In laboratorio si usa più frequentemente il centimetro cubo ( cm3 ).
Quando si devono misurare volumi di fluidi ( liquidi e gas ) si utilizzano comunemente unità di misura non SI dette di capacità; le più importanti sono il litro ( L ) che corrisponde ad 1 dm3 ed il millilitro ( mL ) che corrisponde ad 1 cm3. Pertanto:
1 dm3 = 1000 cm3 = 1 L = 1000 mL ; 1 cm3 = 1 mL.
5.4 - Massa:
Si definisce massa la quantità di materia che costituisce un corpo. E' una proprietà estensiva costante, infatti non varia al variare della posizione del corpo nello spazio ed è indipendente dalla temperatura e dalla pressione. Si misura per confronto con una quantità di materia presa come campione. L'unità di misura SI è il kilogrammo ( kg ). In laboratorio si usano comunemente i suoi sottomultipli, quali, ad esempio il grammo ( g ), corrispondente a 10-3 kg e il milligrammo ( mg ), pari a 10-6 kg.
5.5 - Forza:
La forza ( F ) è una grandezza vettoriale che può essere definita come l'agente fisico in grado di modificare lo stato di moto o di quiete di un corpo; è sempre applicata da un corpo materiale ad un altro ed è caratterizzata da una intensità e da una direzione lungo la quale agisce.
Unità di misura del SI per la forza è il newton ( N ); 1 N corrisponde alla forza capace di imprimere ad un corpo di massa = 1 kg un'accelerazione di 1 m/s2.
5.6 - Peso:
Per peso ( P ) si intende la forza con la quale un corpo è attratto verso il centro della terra. Il peso è, quindi, una forza ed è direttamente proporzionale alla massa del corpo; la costante di proporzionalità è la forza di attrazione gravitazionale ( g ) che, in un dato luogo, è la stessa per tutti i corpi. Per un corpo posto a livello del mare il valore di g è di 9.8 m/s2. La relazione per ricavare il peso è : P = m × g.
L'unità di misura del peso, in quanto forza, è il newton ( N ). In pratica è spesso utilizzato il kilogrammo-peso ( kgp ), ovvero il peso di un corpo avente massa =1kg, posto a 45° di latitudine e a livello del mare; ne deriva che 1kgp = kg 9.8 m/s2 = 9.8 m/s2 e, di conseguenza, 1kgp = 9.8N .
Per esemplificare, il peso di un oggetto portato sulla luna si riduce ad 1/6 del peso che lo stesso aveva sulla terra in quanto la forza di attrazione gravitazionale sulla luna è 1/6 di quella terrestre; ovviamente la massa dell'oggetto rimane invariata.
5.7 - Densità assoluta:
E' una proprietà intensiva della materia, indipendente cioè dall'estensione del campione, ed esprime la massa dell'unità di volume di un corpo omogeneo. In altre parole è data dal rapporto tra massa e volume. La densità si indica, in Italia, con il simbolo d, anche se il SI raccomanda l'uso della lettera greca r ( rho ); l'unità di misura SI è il kilogrammo su metro cubo ( kg/m3 ); comunemente si usa anche il grammo su centimetro cubo ( g/cm3 ).
L'espressione della densità è: d = m / v, da cui deriva V = m / d e m = v · d .
5.8 - Densità relativa:
Rappresenta il rapporto tra la massa di un campione e la massa di un eguale volume di acqua distillata alla temperatura di 4 °C. E' una grandezza adimensionale, espressa, cioè, da un numero puro che rappresenta il rapporto tra due grandezze definite dalla stessa unità di misura. Ad esempio la densità dell'oro è = 19.3, ovvero l'oro ha densità 19.3 volte maggiore di quella dell'acqua distillata a 4 °C.
5.9 - Pressione:
La pressione ( P ) è definita come la forza esercitata sull'unità di superficie: P = forza / superficie.
L'unità di misura della pressione del SI è il pascal ( Pa ) corrispondente a 1N/m2 , ovvero ad una forza di 1 newton che agisce su un'area di 1 m2. Il pascal è una unità molto piccola, per cui comunemente si usano i suoi multipli, l'ettopascal ( 1ePa = 100 Pa ) e il kilopascal ( 1kPa = 1000 Pa ). Molto utilizzato , specie in meteorologia, è il bar che corrisponde a 100000 Pa ed il millibar ( mbar ), corrispondente a 100 Pa e, quindi, sinonimo di ettopascal.
Tradizionalmente sono utilizzate in molti campi diverse unità di misura non-SI, quali, ad esempio, l' atmosfera ( atm ), pari alla pressione esercitata su 1cm2 di superficie, a livello del mare e in una giornata serena, da una colonna di aria alta quanto l'atmosfera. Questo valore corrisponde anche alla pressione esercitata su 1cm2 di superficie da una colonna di mercurio alta 760 mm, alla temperatura di 0 °C.
Ne deriva che 1atm = 760 mm Hg. 1atm corrisponde poi a 101325 Pa e, di conseguenza, a 1013.25 ePa o mbar .
In onore di Evangelista Torricelli, il mm di mercurio è stato chiamato torr : 1mm Hg = 1 torr = 133.32 Pa .
Ricordando, infine, che 1Kgp = 9.8N, si ha la relazione:
![]()
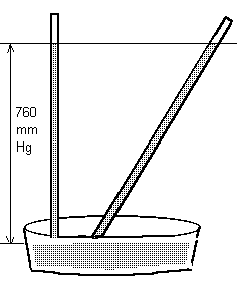
Esperienza di Torricelli
5.10 - Energia:
L'energia è l'attitudine di un corpo a compiere un lavoro. Può presentarsi sotto sei aspetti: meccanica, termica, radiante, elettromagnetica, chimica, nucleare.
- Energia meccanica: è un tipo particolare di energia cinetica; es. energia di una turbina, di un elica.
- Energia termica: è quella accumulata dai corpi quando sono riscaldati senza cambiamenti di stato di aggregazione.
- Energia radiante: è l'energia associata alla luce o ad altre radiazioni elettromagnetiche. Si presenta sotto forma di luce visibile, luce infrarossa o ultravioletta, raggi X, microonde, etc.
- Energia elettromagnetica: energia che proviene dal flusso di corrente elettrica risultante da forze elettriche non bilanciate.
- Energia chimica: energia contenuta nelle sostanze chimiche; le reazioni chimiche permettono che questa energia sia liberata e convertita in altre forme di energia, ad es. luce o calore.
- Energia nucleare: energia prodotta da reazioni di fissione o fusione nucleare.
L'energia si presenta sotto tre forme fondamentali: energia cinetica, energia potenziale ed energia di massa.
Energia cinetica: è l'energia associata al movimento dei corpi. Un corpo di massa m che si muove con velocità v possiede una energia cinetica Ec = 1/2 mv2 .
Energia potenziale ( Ep ): è, ad esempio, quella associata alla posizione di un corpo sul quale agiscono costantemente forze particolari dovute ad altri corpi. Tali forze sono, ad esempio, la forza gravitazionale e le forze di natura elettrica. Un tipo particolare di e.p. è l'energia potenziale chimica che rappresenta il contributo al contenuto energetico totale dovuto alle interazioni tra particelle.
Energia di massa: è l'energia associata alla massa inerziale di un corpo; è espressa dall'equazione di Einstein E = mc2 ove c è la velocità della luce nel vuoto ( ~3 × 108 m/s ) e m rappresenta la massa.
Unità di misura del SI per l'energia è il joule ( J ) che corrisponde al lavoro compiuto dalla forza di 1N quando il suo
punto di applicazione si sposta di 1m nella direzione e nel verso della forza stessa
( 1J = 1N × m ).
In pratica si usano altre unità di misura,
quali la caloria ( cal ), la kilocaloria ( kcal ) e
l'elettronvolt ( eV ) .
Si riportano i fattori di conversione delle unità di misura dell'energia:
joule |
elettronvolt |
caloria |
kilocaloria |
|
joule |
6.242 × 1018 |
0.2389 |
2.389 × 10-4 |
|
elettronvolt |
1.602 × 10-19 |
3.827 × 10-20 |
3.827 × 10-23 |
|
caloria |
4.186 |
2.613 × 1019 |
0.001 |
|
kilocaloria |
4186 |
2.613 × 1022 |
1000 |
Per caloria si intende la quantità di calore necessaria ad aumentare la temperatura di un grammo di acqua distillata da 14.5 a 15.5°C, alla pressione di 1 atm.
5.11 - Calore:
Per calore si intende l'energia termica che passa tra due corpi per effetto di una differenza di temperatura. Se si pongono a contatto un corpo a temperatura più alta ed uno a temperatura più bassa, il secondo riceve calore ceduto dal primo. Questo passaggio è un trasferimento di energia termica che si trovava nel corpo più caldo sotto forma di energia potenziale.
In altre parole, il calore si propaga sempre da zone o corpi più caldi a zone o corpi più freddi.
Unità di misura del calore nel SI è il joule ( J ); come già noto, si utilizzano spesso la caloria ( cal ) e la kilocaloria ( kcal ).
La temperatura è la misura dell'intensità del calore.
L'unità di misura della temperatura è nel SI il Kelvin ( K ) e la sua scala è detta scala assoluta; comunemente si usa il grado centigrado ( °C ) della scala centigrada. Entrambe le unità di misura si equivalgono ( 1K = 1°C ), ma lo zero della scala assoluta è posto a -273.15°C e si chiama zero assoluto. Ne deriva che lo zero della scala centigrada è posto a 273.15 K. Le temperature assolute si indicano con T mentre quelle centigrade con t.
Se con il trasferimento di calore si ha un passaggio di stato il calore trasferito è detto calore latente; a seconda del passaggio di stato si hanno:
Calore latente di fusione: quantità di calore necessaria a far passare 1g di sostanza dallo stato solido a quello liquido. Ad esempio il calore latente di fusione dell'acqua è pari a 80 cal / g:
Calore latente di vaporizzazione o ebollizione: quantità di calore necessaria a far passare 1g di sostanza dallo stato liquido a quello di vapore. Ad es. il calore latente di ebollizione dell'acqua è di 540 cal / g.
La quantità di calore richiesta da una data quantità di sostanza durante il passaggio di stato è data dalla relazione:
Q = calore latente × massa in g della sostanza.
Per calore specifico ( c ) di una sostanza si intende la quantità di calore necessaria a far aumentare di 1°C 1g di sostanza e si esprime, nel SI, in J / g °C; si utilizza anche la cal / g °C.
Per capacità termica ( C ) di un corpo si intende la quantità di calore necessaria a far aumentare di 1°C la sua temperatura; l'espressione è data dal prodotto del calore specifico per la massa del corpo (C = c × m) e si esprime con le stesse unità di misura del calore specifico.
Nelle trasformazioni fisiche ove non abbiano luogo reazioni chimiche o passaggi di stato, un corpo assorbe e cede calore secondo la relazione Q = m × c × D t ( D t = t finale - t iniziale ).
Ad esempio, la quantità di calore necessaria per riscaldare 500 g di ferro ( cmedio = 0.115 cal / g °C) da 50°C a 120 °C è:
Q = 500 g × 0.115 cal / g °C × 70 °C
Q = 4025 cal .
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |