 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Gli stati di aggregazione della materia
ed i passaggi di stato
Materiali occorrenti:
Iodio bisublimato - Sodio - Alcool etilico - Ghiaccio - Pompa per vuoto ad
acqua - Beuta da vuoto - Tubo in gomma da vuoto - Vetreria.
Richiami teorici:
Ogni elemento chimico può esistere allo stato gassoso, allo stato liquido e in quello solido. Il passaggio da uno all'altro di questi stati è detto passaggio di stato.
La maggior parte degli elementi, in condizioni ambientali, si trova allo
stato solido. Fanno eccezione mercurio e bromo che sono allo stato
liquido e neon, elio, argon, kripton, xenon, radon, idrogeno, azoto, ossigeno, fluoro, cloro che sono allo stato gassoso.
Variando la temperatura oppure la pressione ( o entrambe ) ,
ogni elemento può mutare il suo stato fondamentale. Aumentando la temperatura e
diminuendo la pressione si ottiene, di regola, un passaggio solido liquido
gassoso. Ovviamente il percorso inverso lo si ottiene diminuendo la
temperatura ed aumentando la pressione.
Stato solido: le particelle costituenti la materia sono strettamente
unite una all'altra in modo più o meno geometricamente ordinato. Dette
particelle sono dotate di energia propria ed oscillano intorno al proprio punto
di applicazione; da questo non possono, però, muoversi in quanto sono circondate
da altre particelle.
Stato liquido: le particelle hanno una energia cinetica maggiore di
quella dello stato solido, possono muoversi disordinatamente ed urtarsi tra
loro. Minori rispetto allo stato solido sono le forze coesive, tanto che
nell'interfaccia un certo numero di particelle, può sottrarsi del tutto
all'attrazione delle altre, passando allo stato gassoso. I liquidi, infatti,
esistono sempre in presenza del loro gas.
Stato gassoso: le particelle si muovono in maniera caotica e le forze
di coesione sono del tutto trascurabili.
Esiste un quarto stato di aggregazione, il plasma, che si ha portando
un gas a temperature superiori a 5000 °C. In tale situazione uno o più elettroni
esterni si staccano formando uno ione; il plasma è, quindi, formato da cationi e
da elettroni in equilibrio tra loro. Le stelle sono, ad esempio, allo
stato di plasma così come lo è la materia presente nei " tubi al neon ".
Esecuzione dell'esperienza:
Parte prima: fusione del ghiaccio:
Si pone in un becker un cubetto di ghiaccio e si osserva il passaggio
ad acqua liquida che avviene a temperatura ambiente ( fusione ).
Si sottopone poi il becker a moderato riscaldamento coprendolo con un vetro da
orologio; si nota la vaporizzazione dell'acqua. Il vapore d'acqua subito condensa sul fondo del vetro da orologio a causa della temperatura più
bassa di questo trasformandosi, nuovamente in acqua allo stato liquido.
La solidificazione a ghiaccio implica una ulteriore sottrazione di calore che può essere
effettuata solo in un freezer.
Parte seconda: sublimazione dello iodio:
In un becker perfettamente asciutto si pongono alcuni cristalli di iodio,
si copre con un vetro da orologio su cui è posto, come refrigerante, un cubetto
di ghiaccio; si sottopone il becker a moderato riscaldamento sul bunsen e si
osserva uno svolgimento di vapori rossastri, senza la formazione di liquido ( sublimazione ). Sul fondo del vetro da orologio, a causa della sua
temperatura più bassa, si può osservare, dopo pochi secondi, il riformarsi di
cristalli grigiastri di iodio, senza passaggio all'intermedio liquido ( brinamento ).
Lo iodio brinato sul fondo del vetro da orologio può essere eventualmente riconosciuto con trattamento con un solvente apolare, ad esempio tetracloruro di carbonio che lo scioglierà facilmente con il tipico colore rosso-viola.
Parte terza: fusione del sodio:
In una provetta si pone un pezzettino di sodio, circa 2-3 grammi,
avendo cura di asciugarlo perfettamente dal petrolio della conserva. Si porta la
provetta al bunsen fino a completa fusione del metallo, fusione che
avviene a circa 98 °C. La vaporizzazione del metallo è molto più difficile da ottenere in quanto richiede un
riscaldamento a circa 890 °C.
Parte quarta: influenza della pressione sulla temperatura di ebollizione:
Modificando la pressione in cui si opera cambia il punto di ebollizione di un liquido.
Nel caso dell'alcool etilico a pressione ambiente, circa 760 mm di
Hg, la temperatura di ebollizione, ovvero di passaggio allo stato gassoso, è
di circa 78 °C; se si abbassa drasticamente la pressione, utilizzando una
beuta da vuoto collegata ad una pompa ad acqua, è possibile causare il passaggio
allo stato gassoso col solo calore della mano posta sul fondo della beuta.
Si versano nella beuta da vuoto 100 mL circa di alcool etilico commerciale, la si tappa e la si collega tramite un tubo da vuoto alla pompa ad
acqua. La pompa deve essere collegata ad un rubinetto di portata adeguata.
Facendo defluire l'acqua la pompa inizia a creare una depressione all'interno
della beuta; quando la pressione diviene almeno 1/10 di quella ambientale, il
solo calore della mano posta sul fondo della beuta risulta sufficiente a portare
l'alcool etilico all'ebollizione.
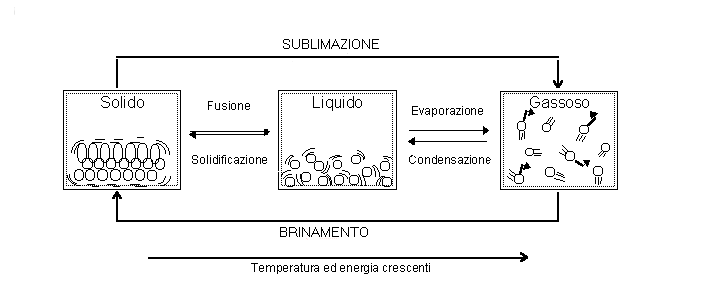
I passaggi di stato
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |