 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
I saggi alla fiamma
Materiali occorrenti:
Sali, possibilmente cloruri, di litio, potassio, sodio, calcio, stronzio,
bario, rame - Fili al nickel-cromo montati - Acido cloridrico sol. 1:3 - Vetri
blu al cobalto - Vetreria.
Esecuzione dell'esperienza:
Si prelevano con una spatola piccole quantità dei sali in analisi, disponendole su un foglio di carta.
Si versano in un vetro da orologio alcuni mL di acido cloridrico sol. 1:3.
Si prende un filo al Ni-Cr e si provvede alla sua pulizia inumidendolo con l'acido e portandolo nella fiamma ossidante ( zona di fusione ) di un bunsen. Tale operazione è completata quando la fiamma appare incolore.
Si inumidisce nuovamente il filo al Ni-Cr con l'acido, si raccolgono sulla punta alcuni cristalli del primo sale in analisi e si osservano il colore ed i caratteri della fiamma.
L'acido cloridrico ha la funzione di permettere l'adesione al filo dei cristalli del sale e di trasformare lo stesso, qualora già non lo fosse, in un cloruro, sale particolarmente volatile. I sali così trattati, ricevendo energia termica dalla fiamma, emettono una radiazione, caratteristica per ogni catione, che viene percepita dall'occhio umano come luce colorata. La radiazione emessa può essere, ovviamente, scomposta da uno spettroscopio nelle righe spettrali in modo da permettere un sicuro riconoscimento del catione.
Si ripete l'esperienza con tutti i sali disponibili, avendo cura di sostituire il filo al Ni-Cr ogni volta, o di pulirlo accuratamente.
E' opportuno annotare, per ogni catione, la colorazione ed i caratteri della
fiamma.
I colori dei principali cationi sono:
Litio: rosso cardinale |
Calcio: rosso mattone |
Sodio: giallo intenso |
Potassio: violetto |
Stronzio: rosso a sprazzi |
Bario: verde pisello |
Rame: verde-azzurro elettrico |
Piombo: grigio-azzurro pallido |
Il sodio è molto persistente e facilmente maschera la presenza di altri cationi, quali, ad esempio, il potassio. La sua radiazione gialla è, però, assorbita dai vetri al cobalto blu per cui, osservando la fiamma attraverso uno o due di questi, è possibile riconoscere perfettamente il catione mascherato.
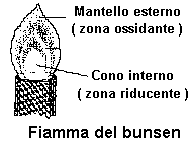
Nota operativa: i fili al nickel-cromo sostituiscono ottimamente quelli classici, e molto più costosi, in platino. La loro resistenza alle ossidazioni è, tuttavia, molto limitata; si consiglia, per questo, di cambiare il filo dopo due o tre analisi. Per facilitare le operazioni si consiglia di usare piccoli pezzi di filo trattenuti da un apposito bastoncino con fermaglio, ovvero da una pinzetta, in luogo di quelli montati su bacchette in vetro.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |