 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
La pila di Leclanch�
Materiali occorrenti:
Pila Leclanché (modello didattico) - Cloruro di ammonio sol. 10 % - Voltmetro
- Amperometro - Lampadina 1.5 V, 0.3 A - Cavi.
Richiami teorici:
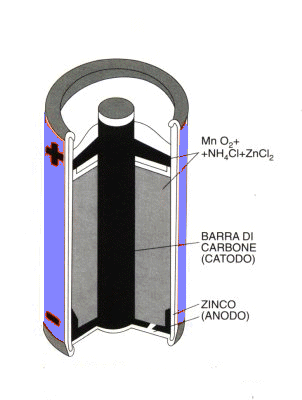
Nella pila a secco di Leclanché le soluzioni ove sono immersi gli elettrodi
sono sostituite da poltiglie gelatinose. Il rivestimento esterno è in zinco ed agisce da anodo ( - ). Una barretta di grafite, immersa nella poltiglia ha
l'esclusiva funzione di conduttore per la stessa, costituita da MnO2, NH4Cl, ZnCl2, nerofumo, amido ed H2O, che svolge le funzioni di catodo ( + ).
Durante il funzionamento lo zinco si ossida mentre il biossido di manganese si riduce.
Le semireazioni sono tuttora discusse, anche se le più
probabili sembrano le seguenti:
| ossidazione | Zn ----> Zn2+ + 2e | E0 = - 0.76 v |
| riduzione | 2MnO2 + 2NH4++ 2e ----> 2MnO(OH) + 2NH3 | E0 = + 0.75 v |
| ------------------------------------------------------------ | ||
| Zn + 2MnO2 + 2NH4+ ----> Zn2+ + 2MnO(OH) + 2NH3 | E0= + 1.51 v |
La f.e.m. espressa dalla pila Leclanché è, quindi, di
circa 1.5 volts.
La pila di Leclanché si scarica quando le reazioni raggiungono
l'equilibrio. Gli ioni Zn2+ prodotti dall'ossidazione
anodica reagiscono con gli ioni della poltiglia con la reazione:
Zn2+ + 2NH4+ + 2OH - ------------> [Zn(NH3)2]2+ + 2H2O .
Questo permette di mantenere bassa la concentrazione di Zn2+ e, di conseguenza,
costante la f.e.m.. Nella pila lasciata a riposo l'ossidazione di questo ione
complesso genera un potenziale maggiore di quello dello zinco, per cui la pila
può recuperare parte della carica.
L'ammoniaca che si libera al catodo isola la barretta
di grafite, interrompendo il flusso di elettroni. La f.e.m. decresce, quindi,
progressivamente.
Esecuzione dell'esperienza:
Si pone l' anodo cilindrico in zinco nel contenitore in
plastica. All'interno del tutto si pone il complesso formato dal cilindro in grafite e dalla poltiglia. Si versa nello spazio rimasto la soluzione
di cloruro di ammonio fino a coprire il tutto. Quest'insieme costituisce
il catodo.
Si collegano, utilizzando due fili di diverso colore, l'anodo ed il catodo
con un voltmetro, rispettando la polarità, e si misura la f.e.m. Questa
risulta pari a circa 1.5 volts.
Dopo si collega la pila all' amperometro e ad un utilizzatore, ad esempio una
lampadina da 1.5 v e 0.3 A, costituendo un idoneo circuito elettrico; si
determina, così, l'intensità della corrente prodotta. Nel caso della pila
didattica tale intensità è pari a circa 0.5 A; essa, quindi, è in grado
di accendere la lampadina.
Al termine dell'esperienza si lavano con cura gli elementi con
acqua corrente e si fanno asciugare all'aria.
La pila di Leclanché
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |