 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
I carboidrati
Materiali occorrenti:
Saccarosio - Glucosio - Fruttosio - Amido - Reattivo di Fehling - Acido
solforico sol. 95 % - Acido cloridrico sol. 37 % - Iodio sol. 0.01 M - Vetreria.
Richiami teorici:
I carboidrati o glucidi sono composti organici, in generale, con formula
elementare Cn(H2O)n.
Presentano dei gruppi -OH, per cui possono essere considerati alcooli
polivalenti e un gruppo aldeidico ( aldosi ) o un gruppo
chetonico ( chetosi ).
I carboidrati più semplici sono i monosaccaridi . Ad
es. ribosio, galattosio e glucosio sono monosaccaridi aldosi; il
fruttosio è un monosaccaride chetoso.
Più unità di monosaccaridi (da 2 a migliaia) possono legarsi
con un legame glicosidico che si stabilisce tra un gruppo -OH di un
monosaccaride ed uno in posizione 1 di un altro monosaccaride, con perdita di
una molecola di H2O.
Se i monosaccaridi sono due si hanno i disaccaridi, tra
i quali: saccarosio ( glucosio + fruttosio ), lattosio ( glucosio +
galattosio) e maltosio ( glucosio + glucosio ).
Se i monosaccaridi sono in numero superiore si hanno i polisaccaridi, tra i quali:
- glicogeno : catena ramificata di α-D-glucosio con legami α-1,4-diglicosidici.
- cellulosa : catena lineare di β-D-glucosio con legami β-1,4-diglicosidici.
- amilosio : catena lineare di α-D-glucosio con legami α-1,4-diglicosidici.
- amilopectina : catena ramificata di α-D-glucosio con legami α-1,4-diglicosidici.
- amido : costituito da amilosio e amilopectina.
I carboidrati a basso peso molecolare sono anche detti zuccheri.
Esecuzione dell'esperienza:
Parte prima: disidratazione del saccarosio:
Il saccarosio, C12H22O11 può essere disidratato a carbonio con perdita di 11 molecole di H2O per azione dell'acido solforico concentrato.
In un vetro da orologio si pongono 10 g circa di saccarosio commerciale e su questi si versano 2 o 3 mL di acido solforico 95 % . In pochi secondi si forma una massa scura. La reazione che è avvenuta è la seguente:
C12H22O11----> 12C + 11H2O .
Parte seconda: esame del potere riducente di alcuni zuccheri:
Come noto gli zuccheri possono presentare un gruppo aldeidico o un gruppo chetonico. Il primo conferisce un potere riducente maggiore del secondo.
Il saccarosio, disaccaride, è formato da una molecola di glucosio e da una di fruttosio legate con legame α-1,2-diglicosidico; per questo non vi sono più gruppi carbonilici liberi con capacità riducenti.
La verifica sperimentale di quanto sopra si effettua con il
reattivo di Fehling, già utilizzato per le aldeidi. In questo reattivo è
presente del Cu2+ , ione dal tipico colore blu, che può essere ridotto a Cu+,
precipitando sotto forma di Cu2O dal colore mattone, per azione di un
agente riducente.
Si preparano 10 mL di reattivo di Fehling completo ( 5 mL sol. A + 5 mL sol. B ) e tre provette contenenti 5 mL circa di acqua distillata. In una provetta si versa una piccola spatolata di glucosio, nella seconda una di fruttosio e nella terza una di saccarosio; si agitano le provette e a ciascuna si aggiungono 3 mL di reattivo di Fehling. Si porta la provetta con il glucosio al bunsen e si scalda; in pochi secondi si nota la formazione del precipitato color mattone di Cu2O. Il Cu2+ si è ridotto a Cu+ e il gruppo aldeidico del glucosio in posizione 1 si è ossidato a gruppo carbossilico, dando l'acido gluconico.
Si pone sul bunsen la provetta con il fruttosio e si nota che il precipitato si forma un po' più lentamente ed appare lievemente meno intenso, ad indicare una minore reattività riduttiva del gruppo chetonico. Nel fruttosio è il gruppo chetonico in posizione 2 che si ossida a gruppo carbossilico.
Riscaldando al bunsen la provetta contenente la soluzione di saccarosio non si forma alcun precipitato, in quanto il disaccaride non presenta siti
carbonilici disponibili per la reazione ossidoriduttiva.
Parte terza: inversione del saccarosio:
Trattando il saccarosio con un acido forte si ottiene la rottura della molecola dei due esosi componenti, il fruttosio e il glucosio. Tale processo è detto inversione e, ovviamente, rende disponibili i siti carbonilici per una reazione ossidoriduttiva.
Il saccarosio invertito può, quindi, ridurre il reattivo di
Fehling.
In due provette con 5 mL di acqua distillata ciascuna
si sciolgono due piccole spatolate di saccarosio commerciale. Una
provetta serve da " bianco ", mentre alla seconda si aggiungono 2 o 3
gocce di acido cloridrico 37 % ; si scaldano entrambe al bunsen ed ad
esse si aggiungono, ciascuna, 3 mL di reattivo di Fehling completo. Solo
la provetta ove ha avuto luogo l'inversione presenta il precipitato di Cu2O.
Parte quarta: idrolisi dell'amido:
L'amido è, come noto, un polisaccaride formato da una catena di monomeri di α-D-glucosio legati da legami α -1,4-diglicosidici.
Lo iodio in soluzione se posto in una soluzione acquosa di amido dà una colorazione blu.
L'azione di un acido forte, ad esempio acido cloridrico, a
caldo porta all'idrolisi del legame glicosidico e quindi al rilascio dei
monomeri; di conseguenza scompare la colorazione blu.
In una provetta si scioglie una punta di spatola di amido solubile in 5 o 6 mL di acqua distillata; alla soluzione si aggiungono alcune gocce di soluzione 0.01 M di iodio che impartiscono il colore blu.
A questo punto, si aggiungono 3 o 4 gocce di acido
cloridrico sol. 37 % e si porta la provetta al bunsen per il riscaldamento; in pochi
secondi il colore blu scompare, indicando la demolizione della molecola del
polisaccaride.
Nota: La reazione di Fehling, riferita ad un monosaccaride generico è:
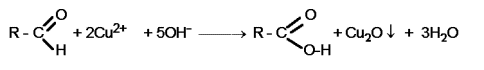
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |