 Didattica della Chimica
Didattica della Chimica Materiali didattici
Materiali didattici Esercitazioni di Laboratorio
Esercitazioni di Laboratorio Sicurezza di Laboratorio
Sicurezza di Laboratorio Atomi e Molecole
Atomi e Molecole Studiare la Chimica
Studiare la Chimica Bisceglia.eu
Bisceglia.eu
Determinazione dell'acidità
dell'olio d'oliva
Materiali occorrenti:
Olio extravergine d'oliva - Idrossido di potassio sol. 0.1 M -
Etere etilico - Alcool etilico assoluto - Fenolftaleina sol. 0.1 % - Buretta da
25 mL - Vetreria.
Richiami teorici:
I grassi e gli oli sono comuni sostanze
alimentari. I grassi sono per lo più di origine animale ( burro, lardo ) mentre
gli oli hanno origine vegetale ( olio d'oliva, olio di semi di mais, olio di
semi di soia, etc. ).
La struttura di base di grassi ed oli è la stessa; sono, infatti, triesteri del glicerolo ( triacil-gliceroli ), ovvero trigliceridi. La struttura base dei trigliceridi è la seguente:
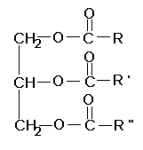
ove R, R' e R'' sono degli acidi
grassi superiori.
Gli acidi grassi possono essere saturi quando presentano legami semplici:
acido laurico : CH3 ( CH2 )10 COOH,
acido palmitico : CH3 ( CH2 )14 COOH,
acido starico : CH3 ( CH2 )16 COOH,
od insaturi quando presentano uno o più doppi legami:
acido oleico : CH3 ( CH2 )7 CH = CH ( CH2 )7 COOH,
acido linoleico : CH3 ( CH2 )4 CH = CH - CH2 CH = CH ( CH2 )7 COOH,
acido linolenico : CH3 CH2 CH = CH - CH2 CH = CH - CH2 CH = CH ( CH2 )7 COOH.
In genere un grasso od un olio contiene più di un AG, anche se
uno è, normalmente, in quantità preponderante. Ad esempio nell'idrolisi dell'olio
d'oliva si ricava circa l' 83 % di acido oleico; dal burro è possibile ricavare
per idrolisi anche più di 15 tipi di AG.
Secondo la legislazione italiana ( DM 31 -10 -1987, n.509 )
l'olio d'oliva è classificato in base all'acidità espressa in acido oleico.
Nell'olio extravergine d'oliva tale acidità in acido oleico deve essere 1 g x
100 g di olio.
La determinazione dell'acidità di un olio si effettua con una titolazione con idrossido di potassio sol. 0.1 M; da questa si ricavano sia il numero di acidità, ovvero i mg di KOH necessari a neutralizzare gli acidi liberi presenti in 1 g di olio, sia l'acidità espressa in %M di acido oleico. Le formule da applicare sono:
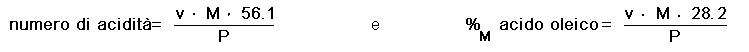
ove v = mL di soluzione di KOH usati, M = molarità della soluzione di KOH e P = massa in g
dell'olio.
La reazione di neutralizzazione che avviene, riferita all'acido
oleico può essere così schematizzata:
CH3(CH2)7CH
= CH(CH2)7COOH + KOH ---> CH3(CH2)7CH = CH(CH2)7COOK
+ H2O .
Esecuzione dell'esperienza:
Si pesano accuratamente su bilancia analitica, in una beuta da
250 mL, 10 grammi di olio in esame. In un cilindro graduato si prepara una miscela 1:3 di alcool
etilico ed etere etilico e la si travasa in una seconda beuta da 250
mL.
Si prepara la buretta sul suo sostegno versando in essa la soluzione di idrossido di potassio 0.1 M, fino alla tacca di zero.
Si prende la beuta contenente la miscela alcool - etere e ad
essa si aggiungono 1-2 mL di fenolftaleina sol. 1 %; poiché la miscela
risulta debolmente acida è necessaria neutralizzarla con alcune gocce di
soluzione di KOH, fatte defluire dalla buretta, fino a evidente colorazione
violetta.
Si aggiunge alla buretta soluzione di idrossido di potassio 0.1 M fino a ripristino del livello allo zero, si travasa la miscela prima
preparata nella beuta contenente l'olio d'oliva, si agita per agita per
alcuni secondi al fine di rendere omogeneo il tutto, che, per la presenza degli
acidi grassi, ritorna incolore.
Si dà inizio alla titolazione gocciolando lentamente il
titolante; al viraggio della soluzione si chiude il rubinetto annotando la
quantità utilizzata.
Siano stati utilizzati 2 mL di idrossido di potassio sol. 0.1 M, applicando le formule citate si ha:
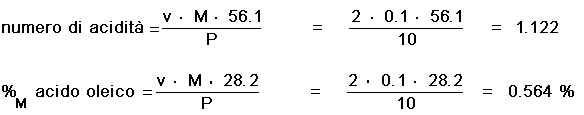
Dai valori ricavati, si evince che l'olio in esame rientra nei
parametri di acidità stabiliti dalla legge.
Nota operativa: la miscela alcool etilico - etere etilico deve essere preparata, se possibile, sotto cappa a causa della volatilità dell'etere. Accertarsi che non siano presenti nelle vicinanze fiamme libere o riscaldatori elettrici in funzione.
Al posto dell'olio d'oliva può essere utilizzato anche un altro tipo di olio vegetale od un grasso solido, ad esempio il burro. In quest'ultimo caso il grasso deve essere preventivamente fuso in modo da permettere una completa soluzione nella miscela.
| Aggiornamento: 17-Lug-2015 14:00 |
| ©Didattica della Chimica- http://www.bisceglia.eu/chimica |